Några forskare har sett över de studier som finns om just GABA.
- Unilever R&D, Bedford, Storbritannien
- 2 Institutionen för psykologi, School of Social Sciences, Nottingham Trent University, Nottingham, Storbritannien
- 3 Institutionen för medicinsk förvaltning och informatik, Hokkaido Information University, Hokkaido, Japan
- 4 Center for Human Psychopharmacology, School of Health Sciences, Swinburne University, Hawthorn, VIC, Australien
Gamma-aminosmörsyra (GABA) är en icke-proteinogen aminosyra och är den huvudsakliga hämmande neurotransmittorn i däggdjurshjärnan. GABAs stressreducerande och sömnförstärkande effekter har fastställts. Men även om flera kliniska prövningar på människa har genomförts, blandas resultaten avseende naturligt och / eller biosyntetiskt oralt GABA-intag på stress och sömn. Vi genomförde en systematisk granskning för att undersöka om naturligt och / eller biosyntetiskt oralt GABA-intag påverkar stress och sömn. Vi sökte systematiskt på PubMed-databasen efter studier publicerade fram till februari 2020 enligt PRISMA-riktlinjer. Endast placebokontrollerade humana prövningar som bedömde stress, sömn och relaterade psykofysiologiska resultat som ett svar på naturlig GABA (dvs. GABA som finns naturligt i livsmedel) eller biosyntetisk GABA (dvs. GABA som produceras via jäsning) intag ingick. Fjorton studier uppfyllde kriterierna och ingick i den systematiska granskningen. Även om det behövs fler studier innan några slutsatser kan göras om effekten av oral GABA-konsumtion på stress och sömn, visar resultaten att det finns begränsat bevis för stress och mycket begränsat bevis för sömnfördelar med oralt GABA-intag.
Introduktion
Gamma-aminosmörsyra (GABA) är en icke-proteinogen aminosyra med fyra kol som finns i bakterier, växter och ryggradsdjur. Ursprungligen upptäcktes det i växter ( Steward et al., 1949 ), det identifierades sedan i däggdjurshjärnan ( Roberts och Frankel, 1950 ) och därefter hos djur ( Roberts och Eidelberg, 1960 ) och flera andra organismer - inklusive bakterier och svampar ( Bouche et al., 2003 ). Hos ryggradsdjur genereras den av den irreversibla a-dekarboxyleringsreaktionen av L-glutaminsyra eller dess salter, katalyserad av glutaminsyradekarboxylasenzym ( Satya Narayan och Nair, 1990 ) och fungerar som en hämmande neurotransmittor i centrala nervsystemet (CNS) (Roberts och Frankel, 1950 ; Petroff, 2002 ), Det har också hittats i flera perifera vävnader ( Erdö, 1985 ). GABA är avgörande för CNS-funktionen, där ~ 60–75% av alla synapser är GABAergiska ( Schwartz, 1988 ).
Förutom sin roll som neurotransmittor finns GABA också naturligt i olika livsmedel, såsom te, tomat, sojabönor, grodd ris och vissa fermenterade livsmedel, och kan erhållas från en normal diet ( Diana et al., 2014 ; Rashmi et al., 2018 ). Till exempel innehåller vitt te och adzukibönor 0,5 respektive 2,01 g / kg GABA ( Zhao et al., 2011 ; Liao et al., 2013 ). Å andra sidan kan mycket högre koncentrationer av GABA produceras genom mjölksyrabakterier (LAB) fermentering ( Dhakal et al., 2012 ). Genom att till exempel använda Lactobacillus brevis NCL912-stam, kunde 103,5 g / l GABA produceras ( Li et al., 2010). Nyligen har LAB GABA fått betydande uppmärksamhet och har i stor utsträckning använts som en funktionell livsmedelsingrediens på olika marknader på grund av dess potentiella hälsofördelar associerade med GABA ( Boonstra et al., 2015 ).
Det är värt att nämna att GABA länge har ansetts vara oförmöget att korsa blod-hjärnbarriären (BBB) ( Kuriyama och Sze, 1971 ; Roberts, 1974 ), vilket väcker frågor om verkningsmekanismerna bakom dess hälsofördelar. Det finns dock olika konton angående GABA: s BBB-permeabilitet. Medan vissa forskare hävdar att endast små mängder GABA korsar BBB ( Knudsen et al., 1988 ; Bassett et al., 1990 ), med upptäckten av GABA-transportsystem i hjärnan (dvs. överföring av lösta ämnen genom transcytos, bärare -medierad transport, eller enkel diffusion av hydrofoba ämnen), andra tror att de betydande mängderna av GABA skulle kunna korsa BBB ( Takanaga et al., 2001 ;Al-Sarraf, 2002 ; Shyamaladevi et al., 2002 ). Eftersom GABA också är närvarande i det enteriska nervsystemet har man ansett att GABA kan verka på det perifera nervsystemet genom tarm-hjärnaxeln ( Cryan och Dinan, 2012 ). Även om det finns vissa bevis som visar att biosyntetisk GABA kan nå den mänskliga hjärnan, vilket framgår av olika EEG-svar ( Abdou et al., 2006 ; Yoto et al., 2012 ), hittills finns det inga data som visar GABA: s BBB-permeabilitet hos människor. Även om det har visats att GABA-nivåerna i blodet höjdes 30 minuter efter oralt GABA-intag ( Yamatsu et al., 2016 ), är det inte känt om oralt GABA-intag skulle öka GABA-koncentrationer i hjärnan eller inte.
Med tanke på den allestädes närvarande rollen som GABA som en hämmande neurotransmittor, tillsammans med dess utbredda distribution, är det inte förvånande att det har varit inblandat i ett stort antal beteenden ( Olney, 1990 ). Dessa inkluderar ångest- och stressreglering, dygnsrytm och sömnreglering, minnesförbättring, humör och till och med upplevelse av smärta ( Diana et al., 2014 ; Rashmi et al., 2018 ). Låga nivåer av GABA eller nedsatt GABA-funktion är associerad med etiologi och upprätthållande av akut och kronisk stress ( Jie et al., 2018 ), ångeststörningar ( Nemeroff, 2003 ) och sömnstörningar som sömnlöshet ( Gottesmann, 2002). Specifikt reglerar GABAergiska nervceller och neurotransmittorer hjärnkretsarna i (i) amygdala för att modulera stress och ångestsvar både under normala och patologiska förhållanden ( Nuss, 2015 ), (ii) kortikomedulära vägar för att modulera både snabb ögonrörelse (REM ) och icke-REM, särskilt långsam sömn (SWS) ( Luppi et al., 2017 ) och (iii) de suprachiasmatiska kärnorna (SCN) för att modulera dygnsrytmen ( DeWoskin et al., 2015 ). Allosteriska platser på GABAa-receptorerna tillåter också att nivån av hämning av nervceller i relevanta hjärnregioner regleras med hög noggrannhet, och dessa platser är de molekylära målen för både ångestdämpande och hypnotiska läkemedel ( Nuss, 2015 ; Riemann et al., 2015). Därför använder den farmakologiska behandlingen av ångeststörningar och sömnlöshet vanligtvis en bensodiazepinreceptoragonist som påverkar GABAergic transmission ( Nemeroff, 2003 ; Riemann et al., 2015 ) som verkar genom att öka bindningen av GABA till GABAa-receptorer för att förbättra hämmande signaler till cellgrupper som reglerar upphetsning. Detta resulterar i minskad stress och ångest, minskad sömnlatens och ökad sömnkontinuitet ( Gottesmann, 2002 ; Nemeroff, 2003 ; Nuss, 2015 ).
Medan ett begränsat antal mänskliga prövningar med ett brett spektrum av metoder (när det gäller dosen GABA, interventionens varaktighet och åtgärder som används för att bedöma stress och sömn) har undersökt effekten av icke-farmakologiska metoder för att minska stress och förbättra olika aspekter av sömn genom att använda naturligt och biosyntetiskt GABA-intag, så vitt vi vet har detta forskningsområde inte granskats systematiskt. Trots den höga metodologiska variationen i studierna som ingår i den aktuella granskningen är syftet med denna granskning att genomföra en systematisk granskning och bedöma robustheten i vetenskapliga bevis som stöder de positiva effekterna av oralt GABA (naturligt eller biosyntetiskt) intag på stress, sömn och relaterade psykofysiologiska åtgärder.
Metoder
Urval av studier
Inklusionskriterier
Inklusionskriterierna var följande:
• Resultatmått: stress, ångest, sömn och / eller relaterade psykofysiologiska parametrar
• Design: randomiserade kontrollerade studier och kvasi-experimentella studier
• Deltagare: Alla åldrar eller kön, friska eller ohälsosamma deltagare.
Exklusions kriterier
Uteslutningskriterierna var följande:
• Produkt: Syntetisk GABA (dvs. farmaceutiska ämnen)
• Design: Fallrapport, brev till redaktör, konferensbidrag, avhandling, personlig åsikt eller kommentar
• Djurstudier, in vitro- och ex vivo- studier.
Datakällor och sökstrategi
Vi genomförde en elektronisk litteratursökning på PubMed för att identifiera relevanta studier. Sökningen genomfördes fram till början av februari 2020. Söksträngarna som användes vid sökning var GABA OCH (stress ELLER sömn) INTE (gabapentin ELLER pregabalin). Artiklar valdes enligt föredragna rapporteringsartiklar för systematiska granskningar och metaanalyser (PRISMA) -diagrammet ( Moher et al., 2015 ; Shamseer et al., 2015 ). En granskare (PH) valde självständigt papper enligt ovannämnda kriterier för inkludering och uteslutning. Följande information extraherades från alla publikationer:
• Publikationsinformation : författare, år, tidskrift
• Deltagaregenskaper : antal rekryterade deltagare, antal deltagare som ingår i studien, antal deltagare (intervention), antal deltagare (kontroll), antal deltagare (annan intervention), hälsostatus, kön och åldersintervall
• Studiedesign : design och förblindning
• Interventionsegenskaper : interventionstid, tvättperiod, GABA-format, GABA-typ (naturlig eller biosyntetisk), GABA-dos, andra interventionstyper och doser
• Kontrollegenskaper : närvaro / frånvaro av kontroll / placebo, kontroll / placebodoser
• Resultatmått : frågeformulär för stress och sömn, kortisol, kromogranin A (CgA), immunglobulin A (IgA), adrenokortikotropiskt hormon (ACTH), adiponektin, hjärtfrekvens och hjärtfrekvensvariation, blodtryck, EEG-variabler
• Anmärkningar : anteckningar om de faktorer som kan påverka resultat / datakvalitet.
Studiekvaliteten bedömdes också med hjälp av Cochrane Collaborations verktyg för att bedöma risken för partiskhet i randomiserade studier ( Higgins et al., 2011 ).
Resultat
Vi identifierade 5 912 publikationer och screenade dem för att vara berättigade med hjälp av inkludering och uteslutningskriterier. Inledningsvis exkluderades 3 989 djurstudier, därefter ytterligare 10 in vitro- studier på människor. Ett tusen trehundra fyrtiosex studier som inte mätte stress och sömnrelaterade resultat exkluderades. Slutligen uteslöts 554 studier som inte undersökte konsumtionen av naturlig eller biosyntetisk GABA. Fjorton studier uppfyllde alla inklusionskriterier inkluderades i denna översyn ( figur 1 ).
En granskare (PH) utvärderade kvaliteten på de studier som ingår i denna granskning med hjälp av Cochrane Collaborations verktyg för att bedöma risken för partiskhet i randomiserade studier ( Higgins et al., 2011 ; Figur 2)). Majoriteten av studierna kategoriserades som med en oklar risk för selektionsbias, eftersom endast en av dem rapporterade metoden som användes för slumpmässig sekvensgenerering och allokeringsdöljning. Prestationsförskjutning, detektionsbias och förslitning observerades ha låg risk eftersom de flesta studierna var dubbelblinda och rapporterade alla resultaten. Risken för att rapportera bias var oklar eftersom vi inte var säkra på om forskare analyserade och rapporterade alla resultat som kunde extraheras från deras valda metoder. Slutligen fanns det en oklar fördom för potentiell intressekonflikt eftersom en eller flera författare till elva studier var anställda av ett industriföretag vid tidpunkten för publiceringen.
Sammanfattningar av alla studier presenteras i Tabell 1 (Metoder) och Tabell 2 (Resultat).
Effekten av GABA-konsumtion på stress
Två experimentella studier undersökte effekten av att konsumera GABA-berikade naturprodukter (som te och ris) på stress. Även om majoriteten av deltagargrupperna rapporterades vara friska varierade dosen GABA, interventionens varaktighet och de åtgärder som användes för att bedöma stress avsevärt.
En nyligen genomförd studie av Hinton et al. (2019) som undersökte de akuta effekterna av GABA Oolong-konsumtion på stress visade att både GABA Oolong-te (2,01 mg GABA / 200 ml te) och standard Oolong te (0,25 mg GABA / 200 ml te ) undersöktes ) ökat genomsnittligt RR-intervall (tiden mellan två på varandra följande R-vågor i elektrokardiogrammet). GABA Oolong hade emellertid ett större inflytande på hjärtfrekvensvariabilitet (HRV), vilket framkallade en större förändring i RR-intervallet hos höga jämfört med lågt stressade individer. Effekterna av GABA på andra HRV-parametrar och subjektiv stress var inte signifikanta. En annan studie av Yoshida et al. (2015)visade att 8 veckors konsumtion av GABA-ris (16,8 mg GABA i 150 g GABA-ris / dag) förbättrade den subjektiva lugn och oro i mitten av studien vid den fjärde behandlingsveckan jämfört med vitt ris (4,1 mg GABA i 150 g GABA-ris / dag) bibehölls dock inte dessa effekter. De rapporterade också trender för minskad blodkortisol och ökade adiponektinnivåer i tillståndet GABA-ris (mot vitt ris) vid den 8: e veckan av behandlingen. De observerade emellertid inga effekter på adrenokortikotropiskt hormon (ACTH) under något stadium av interventionen.
Alla de åtta experimentella studierna undersökte effekterna av (i) singel ( Abdou et al., 2006 ; Fujibayashi et al., 2008 ; Nakamura et al., 2009 ; Okita et al., 2009 ; Kanehira et al., 2011 ; Yoto et al., 2012 ; Yamastsu et al., 2015 ) och (ii) upprepade ( Yamatsu et al., 2013 ) biosyntetisk GABA-konsumtion på stress - främst på psykofysiologiska parametrar, med doser mellan 20-100 mg och deltagarnas antal mellan 7–63.
Fujibayashi et al. (2008) visade att 30 mg GABA-intag ökade (i) total effekt (TP) 30 och 60 minuter efter intag jämfört med baslinjen och (ii) högfrekvent effekt (HF) 30 min efter intag jämfört med baslinjen, men de misslyckades med att visa mellan gruppskillnader och skillnader i andra HRV-parametrar. Däremot Okita et al. (2009) rapporterade att placebotabletten ökade LF / HF-förhållandet och hjärtfrekvensen (HR) 20 och 40 minuter efter konsumtion. Denna ökning observerades inte i GABA-tillståndet (31,8 mg GABA), men de fann effekterna av GABA-konsumtion på andra parametrar inklusive strokevolym, hjärtutgång, HF- och LF-effekt, systoliskt blodtryck (SBP), diastoliskt blodtryck (DBP ) och genomsnittligt blodtryck (MBP). Använd elektroencefalografi (EEG), experiment 1 frånAbdou et al. (2006) visade att 100 mg GABA i 200 ml vatten ökade förändringar i (i) alfa-vågor (jämfört med vattentillstånd) och (ii) alfa / beta-förhållande (jämfört med vatten och teanintillstånd). De rapporterade också en trend för minskade förändringar för betavågor i GABA jämfört med vattenförhållanden. Den enda 4 veckors långa interventionsstudien med biosyntetisk GABA observerade en ökning av kortisolnivåerna i placebogruppen efter 2 och 4 veckors GABA-användning, men GABA-gruppen visade inte en sådan ökning ( Yamatsu et al., 2013 ).
De andra studierna använde olika metoder för att inducera stress hos deltagarna. Yamastsu et al. (2015) använde Uchida-Kraepelin Psychodiagnostic Test (UKT; Kuraishi, 2000 ), en aritmetisk uppgift för att inducera stress, och visade att 20 mg GABA i kaffe (jämfört med endast kaffe och vattenförhållanden) minskade kromogranin A (CgA) nivåer 30 min efter konsumtion. En liknande studie med användning av UKT- och CgA-nivåer ( Kanehira et al., 2011 ) visade att konsumtion av både 25 och 50 mg GABA i en 250 ml hypoton dryck (jämfört med endast hypotonisk dryck) sänkte salivcgA och kortisol hos individer med kronisk trötthet . Den subjektiva spänningen / ångestpoängen var dock inte signifikant. Nakamura et al. (2009)mätt både CgA och HRV och fann att 28 mg GABA i 10 g choklad, jämfört med 20 g choklad ensamt, minskade LF / HF-effekten 6,5-9,5 min efter den aritmetiska uppgiften (dvs = 36,5-39,5 min efter intag) HF-effekten 12–15 minuter efter den aritmetiska uppgiften (dvs. = 42–45 min efter intag). De rapporterade också att CgA-värdena ökade i chokladets enda tillstånd 30 och 50 minuter (jämfört med baslinjen) efter intag, en effekt som inte observerades i GABA-chokladtillstånd. Den elektrofysiologiska studien av Yoto et al. (2012)använde EEG för att visa att UKT minskade alfa- och beta-bandeffekten, medan 30 minuter efter ett 100 mg GABA-kapsel (vs. placebokapsel) intag hade denna minskning minskat. Även om deltagarna inte rapporterade en subjektiv ökning av avslappning och minskning av spännings / ångest och upphetsningspoäng. Till skillnad från studierna ovan, experiment 2 från Abdou et al. (2006) använde däremot en verklig stressuppgift där akrofoba deltagare ombads att korsa en upphängd bro. De upptäckte att kontrollgrupperna immunglobulin A (IgA) nivåer minskade i mitten och slutet av bron, men 100 mg GABA kapselgrupper IgA-nivåer visade inte detta mönster.
Effekten av GABA-konsumtion på sömn
Två åtta veckors interventionsstudier undersökte effekten av att konsumera GABA-berikat ris på sömnen hos friska individer. Yoshida et al. (2015) , som studerade friska medelålders individer med dålig sömn, fann en trend för förbättrade känslor vid uppvaknande i GABA-ris (16,8 mg GABA i 150 g GABA-ris / dag) (vs. vitt ris − 4,1 mg GABA i 150 g vitt ris / dag) grupp vid den fjärde interventionsveckan och efter två veckors intervention (dvs. vid den 10: e veckan). De fann ingen effekt av GABA-ris på VAS-sömnighetspoäng. Omvänt Okada et al. (2000)rapporterade hos postmenopausala kvinnor att konsumtionen av 26,4 mg GABA-ris 3 gånger om dagen (jämfört med kontrollris) förbättrade sömnlöshetspoängen för Kupperman klimakteriet vid den fjärde veckan av behandlingen. Dessutom undersökte endast en fyra veckors lång studie effekten av biosyntetisk GABA-konsumtion på sömn hos friska äldre deltagare. Med hjälp av OSA-sömninventariet visade de förbättringar i början och underhållet av sömn, sömnighet på morgonen och återhämtning från trötthetsvärden i GABA-gruppen efter 4 veckors behandling, även om de inte fann skillnader mellan GABA och placebogrupper ( Yamatsu et. al., 2013 ).
Tre interventionsstudier på 1 till 3 veckor (om än med mycket låga provstorlekar) undersökte effekterna av biosyntetisk GABA-konsumtion på sömn hos individer med dålig sömnkvalitet (en med PSQI> 5 målskyttar och två med PSQI> 6 målskyttar; PSQI : Pittsburgh Sleep Quality Index). I sin första 1 veckors långa interventionsstudie, Yamatsu et al. (2016)visade att intaget av 100 mg GABA-kapsel (kontra kontroll) förbättrade känslor vid uppvaknande, objektivt uppmätt minskad sömntid och ökad total sömntid för icke-REM (N1, N2 och N3 / SWS) efter ingrepp. De observerade också trender för förbättrad PSQI, sömntillfredsställelse och lättare att somna poäng och ökad ljus Icke-REM sömntid och sömneffektivitet i GABA (kontra kontroll) tillstånd efter behandling. De hittade emellertid inte signifikanta effekter för djup icke-REM (N3 / SWS) sömntid och tid (dvs varaktighet), REM-sömntid, uppvaknande frekvens eller delta vågkraft. I deras andra interventionsstudie på 1 vecka, Yamatsu et al. (2015), som studerade medelålders sovande som rapporterade att de hade dålig sömn, observerade en trend för minskad sömnfördröjning endast i 100 mg GABA kapsel (kontra kontroll) tillstånd. Resultat från PSQI-total, sömntillfredsställelse, känsla av att vakna, lätthet att somna poäng och icke-REM-sömntidsfördröjning, REM-sömntid, icke-REM-sömntid, uppvaknande frekvens och delta-vågkraft var inte signifikanta för GABA endast jämfört med annan intervention (AVLE och AVLE + GABA) och kontrollgrupper. Den senaste 4 veckor långa interventionsstudien på detta område av Byun et al. (2018), som studerade medelålders sovande som rapporterade att de hade dålig sömn rapporterade att intaget av 300 mg GABA-tablett (kontra kontrolltablett) minskade sömnstiden efter interventionen. De fann också att N2-sömn (%) och sömnlöshetsindex (ISI) minskade, liksom PSQI-total, PSQI-sömnkvalitet, PSQI-sömnlatens och PSQI-total sömntidspoäng i GABA-gruppen (före vs. efterbehandling) emellertid misslyckades de med att hitta skillnader mellan GABA och placebo / grupp. Dessutom fanns inga statistiskt signifikanta effekter av PSQI-sömneffektivitetspoäng och total sömntid, steg 1 och 3 Icke-REM-sömn (%), REM (%), vakna efter sömnstart (WASO; min), REM- sömnfördröjning, sömneffektivitet, upphetsningsindex, apné-hypopneaindex (AHI) och andningsbesvär (RDI).
Diskussion
Sammanfattning av de viktigaste resultaten
Denna systematiska granskning syftade till att fastställa den nuvarande statusen för kunskap om effekterna av naturlig och biosyntetisk GABA-konsumtion på stress och sömn. Sammantaget visade vår genomgång av litteraturen att det fanns låga till måttliga bevis för GABAs stress (på grund av att det finns fler studier med positiva resultat) och låga bevis för GABAs sömnfördelar.
Metoderna för studierna som ingår i denna översikt varierade signifikant men inkluderade både subjektiva och objektiva mått på stress och sömn. Majoriteten av studierna fann inte signifikanta subjektiva förbättringar av stresspoäng efter att ha konsumerat en enda dos av antingen naturliga eller biosyntetiska former av GABA. Bevis för utökad GABA-användning är blandad, Yoshida et al. (2015) studie som rapporterade förbättrad lugn och oro i GABA (vs. kontroll) -gruppen vid den fjärde behandlingsveckan, men inte med GABA-användning utöver det. Å andra sidan förbättrades bara några av de subjektiva sömnvärdena inklusive sömnstörningar, känslor vid uppvaknande, insättande och underhåll av sömn, sömnighet på morgonen och återhämtning från trötthetsresultat när det var en långvarig användning av GABA i minst en vecka (Okada et al., 2000 ; Yamatsu et al., 2013 , 2016 ). Återstående studier visade antingen trender mot förbättringar eller obetydlig subjektiv förbättring av sömnen. Det kan mycket väl vara så att långvarig naturlig användning av GABA krävs för att framkalla subjektiv stress och sömnfördelar.
Påfrestning
På grund av GABA: s BBB-permeabilitetsproblem använde de flesta studierna autonoma nervsystemet (ANS) -relaterade åtgärder (såsom HRV, kortisol och CgA) för att undersöka effekterna av GABA-konsumtion på stress. Abdou et al. (2006) och Yoto et al. (2012) använde EEG för att utvärdera den centrala effekten av GABA. Studierna med ANS-relaterade åtgärder visade positiva men ganska motstridiga resultat. Hinton et al. (2019) rapporterade ökade RR-intervall i GABA-tillståndet som återspeglar mer stabil ANS-funktion genom en ökning av vagal aktivitet (indikerar minskat stressrespons) ( Camm et al., 1996 ). På samma sätt, även om inga behandlingsskillnader rapporterades mellan GABA och kontrollförhållanden, Fujibayashi et al. (2008)visade en ökad TP i GABA-tillstånd 30 och 60 minuter efter intag (jämfört med baslinjen) vilket indikerar ANS-funktionalitet och anpassningsförmåga och minskad stress ( Camm et al., 1996 ). Samma studie rapporterade ökad HF i GABA-tillstånd 30 minuter efter intag (jämfört med baslinjen) vilket indikerar ökad PNS-aktivitet och minskad stress ( Berntson et al., 1997 ). Ökade RR-intervall, TP och HF antyder att GABA utövar sina effekter genom parasympatisk förstärkning utan eller mindre sympatiska effekter.
Resten av studierna som använde ANS-mått visade det motsatta aktiveringsmönstret. LF / HF, en markör för SNS-aktivitet och sympatovagal balans som ökar under stressförhållanden ( Pagani et al., 1991 ) ökade antingen inte ( Okita et al., 2009 ) eller reducerades i GABA-tillståndet ( Nakamura et al., 2009 ). På liknande sätt CgA, ett protein som frigörs tillsammans med noradrenalin i SNS ( Dimsdale et al., 1992 ) och kortisol, ett glukokortikoidhormon som frigörs av binjurebarken via (i) frisättning av adrenokortikotrop hormon genom reglering av hypotalamus-hypofysen - binjurexeln och (ii) SNS-innerveringen ( Engeland och Arnhold, 2005 ) reducerades i GABA kontra kontrollförhållanden (Nakamura et al., 2009 ; Kanehira et al., 2011 ; Yamastsu et al., 2015 ), vilket indikerar minskade stressnivåer. Dessutom befanns IgA, ett glykoprotein som regleras av SNS ( Carpenter et al., 1998 ) som är lägre i ångest ( Graham et al., 1988 ), minskat i kontroll men inte under GABA-förhållanden under en stressig uppgift. ( Abdou et al., 2006 ), vilket tyder på en stressskyddande effekt av GABA. Enligt dessa studier inducerade GABA avkoppling genom att modulera det sympatiska nervsystemet.
Även om det inte finns någon enighet om vilken uppdelning av det autonoma nervsystemet som påverkas mest av GABA-intaget, finns det begränsade bevis för att GABA också korsar BBB och utövar biologiska effekter på CNS. Stressreduktion och avkoppling är förknippade med förbättrade alfasvängningar ( Nobre et al., 2008 ), minskad betaaktivitet ( Ray och Cole, 1985 ) och ökat alfa / beta-förhållande ( Liang et al., 2019 ; Yi Wen och Mohd Aris, 2020 ). I linje med detta har Abdou et al. (2006) observerade ökade förändringar för alfa-vågor och alfa / beta-förhållande i GABA (vs. placebo) tillstånd, vilket tyder på förbättrad avkoppling. På samma sätt har Yoto et al. (2012)rapporterade att både alfa- och beta-vågor minskade på grund av en stressuppgift, men 30 minuter efter GABA-intag minskade denna minskning i GABA (kontra kontroll) tillstånd, vilket indikerar en stressskyddande effekt av GABA. Dessa resultat antyder att GABA passerar BBB antingen i små eller fulla mängder för att utöva biologiska effekter på CNS.
Sammanfattningsvis verkar stressmarkörer för båda divisionerna av ANS och CNS påverkas av oralt GABA-intag. Det är dock viktigt att notera att de effektiva doserna för stressreducerande och / eller stressskyddande fördelar varierar från 2,01 till 100 mg, där de lägre doserna upp till 30 mg verkar påverka de autonoma markörerna för stress och en dos på 100 mg. verkar påverka de centrala markörerna för stress. Dessutom verkar effektiva doser för naturlig GABA vara lägre än för biosyntetiska former. Även om naturligt GABA-intag och stressforskning är mycket begränsat kan dessa resultat också hänföras till de andra bioaktiva föreningarna som finns naturligt i livsmedel som har stressreducerande fördelar såsom l-theanin ( Juneja et al., 1999 ) och epigallocatechin gallate (EGCG) i te ( Scholey et al., 2012). Ytterligare studier är motiverade för att undersöka (i) naturlig och biosyntetisk GABA-biotillgänglighet hos människor efter oralt intag för att förstå GABAs verkningsmekanism för varje typ av GABA, (ii) minimala och optimala naturliga och biosyntetiska GABA-doser som krävs för stressfördelar, och (iii) minimala och optimala naturliga och biosyntetiska GABA-doser som krävs för att påverka stressreduktion / avslappning perifert och centralt.
Sömn
Det finns bara mycket begränsade stödjande bevis för rollen av oralt GABA-intag för objektiv sömnförbättring. Byun et al. (2018) , vars deltagare fick dos 1 timme innan de sov, rapporterade att användning av GABA under fyra veckor minskade sömnfördröjningen i GABA-gruppen (vs. kontroll). På liknande sätt har Yamatsu et al. (2016) , med dosering 30 minuter före sömn, visade att en veckas GABA-intervention minskade sömnstiden och ökade den totala sömntiden för icke-REM i GABA (kontra kontroll) tillstånd. I en tidigare studie med samma doseringsregim, Yamatsu et al. (2015)observerade endast en trend mot minskad sömnfördröjning efter 1 veckas GABA-konsumtion. Alla tre studierna misslyckades med att visa fördelaktiga effekter av GABA-intag på andra sömnmarkörer, såsom sömneffektivitet, REM-sömntid, uppvakningsfrekvens etc. Dessa resultat tyder på att långvarigt GABA-intag (dvs. upprepad dosering över dagar) kan vara fördelaktigt för naturligt inducerande sömn snarare än att upprätthålla sömn, eftersom bevis visade att GABA främst påverkar sömnstart och tidiga sömnstadier som inträffar tidigt på natten (dvs. nattens första icke-REM), men inte de sömnstadier som inträffar senare på natten. Detta kan förklaras av den farmakokinetiska profilen för GABA, som kännetecknas av en snabb ökning (30 minuter efter oral administrering) och sedan minskning (60 minuter efter oral administrering) i plasmakoncentrationer. Med andra ord, den snabba höjningen i blodet kan GABA-nivåerna förklara varför det påverkar differentiellt tidiga sömnmarkörer. Dessutom finns det ett dubbelriktat samband mellan sömn och både akut och kronisk ångest där sömnstörningar observeras hos individer med ångest (Soehner och Harvey, 2012 ) och sömnstörningar kan förutsäga utvecklingen av en ångestsyndrom ( Neckelmann et al., 2007 ). Specifikt har ökad latens för sömn observerats vid ångest och relaterade störningar ( Cox och Olatunji, 2016 ) och stress ( Maskevich et al., 2020 ). Därför kan fördelarna med tidigt sömnstadium med GABA-konsumtion förknippas med GABAs stressreducerande egenskaper snarare än direkt sömnframkallande och / eller upprätthållande av fördelar i sig.. Bristen på sömnunderhållsrelaterade fördelar med GABA kan också förklaras av (i) små och ojämna gruppstorlekar som maskerar verkliga förbättringar, (ii) otillräckliga GABA-mängder som inte driver SWS- och REM-svar och (iii) som inte använder split -natt PSG / EEG och maskering av de betydande förändringar som bara kan vara uppenbara i olika delar av natten.
Upprepat GABA-intag över dagar kan förbättra parametrarna för tidig sömn; Det är dock viktigt att notera att doser som krävs för att framkalla sömnfördelar (mellan 100 och 300 mg för biosyntetisk GABA) verkar vara högre än för stressfördelar (varierar mellan 20 och 100 mg för biosyntetisk och 2,01 och 26,4 mg för naturliga GABA) och verkar kräva en långvarig användning (1–8 veckor) för att bara förbättra tidiga sömnåtgärder. Med detta sagt verkar doser som sträcker sig mellan 100 och 300 mg vara effektiva för att minska sömnstiden med långvarig användning av 1–4 veckor. Återigen är det viktigt att notera att alla sömnstudier som rapporterade förbättrade objektiva sömnmått använde biosyntetiska former av GABA. Framtida forskning krävs för att förstå (i) de minimala och optimala naturliga och biosyntetiska GABA-doserna som krävs för att påverka olika sömnsteg,
Begränsningar
Den pågående översynen var föremål för flera begränsningar. För det första var kvaliteten på många av de granskade studierna tveksam på grund av potentiella intressekonflikter, lågt deltagande antal och ojämna kontroll- och interventionsgrupper. För det andra har inte alla studier bedömt samma stress- och / eller sömnparametrar eller använt samma design, varför ingen kvantitativ metaanalys kunde utföras på grund av heterogeniteten hos de extraherade data. För det tredje, även om PICOS (patientintervention-kontroll-utfall-studiedesign) användes för att extrahera data, fanns det bara en datautdragare och inget validerat verktyg har använts. Slutligen, på grund av det begränsade antalet heterogena studier inom detta område, kunde den exakta dosen för effektivitet för både stress- och sömnfördelar inte fastställas varken i den aktuella översynen eller i den allmänna vetenskapliga litteraturen. Därmed,
Slutsats
Denna översikt erbjuder en omfattande bedömning av den aktuella GABA-litteraturen och visar att naturligt och biosyntetiskt GABA-intag kan ha fördelaktiga effekter på stress och sömn. På grund av små provstorlekar och heterogenitet hos de använda metoderna är det dock nödvändigt med ytterligare forskning för att fastställa dostid, varaktighet och svarsförhållanden för både naturliga och biosyntetiska former av GABA för att på ett tillförlitligt sätt framkalla akut eller kronisk stress och sömneffekter.
Uttalande om datatillgänglighet
Alla datamängder som presenteras i denna studie ingår i artikeln.
Författarens bidrag
PH skrev manuskriptet med inmatning från JG, JN och AS som också bidragit till revisionen av manuskriptet kritiskt för viktigt intellektuellt innehåll. Alla författare bidrog till artikeln och godkände den inlämnade versionen.
Finansiering
Erhållna medel från Unilever UK Central Resources Limited för att täcka publiceringsavgifter för öppen tillgång.
Intressekonflikt
PH är anställd av Unilever UK Central Resources Limited. JG, JN och AS har fått forskningsfinansiering, konsulttjänster, resestöd och talaravgifter från olika industriföretag.
Referenser
Abdou, AM, Higashiguchi, S., Horie, K., Kim, M., Hatta, H. och Yokogoshi, H. (2006). Avslappnings- och immunförstärkningseffekter av gamma-aminosmörsyra (GABA) -administrering hos människor. Biofaktorer 26, 201–208. doi: 10.1002 / biof.5520260305
Al-Sarraf, H. (2002). Transport av 14C-gamma-aminosmörsyra till hjärnan, cerebrospinalvätska och koroid plexus hos nyfödda och vuxna råttor. Dev. Brain Res. 139, 121–129. doi: 10.1016 / S0165-3806 (02) 00537-0
Bassett, ML, Mullen, KD, Scholz, B., Fenstermacher, JD och Jones, EA (1990). Ökat hjärnupptag av γ-aminosmörsyra i en kaninmodell av leverencefalopati. Gastroenterologi 98, 747-757. doi: 10.1016 / 0016-5085 (90) 90298-F
Berntson, GG, Bigger, JT Jr, Eckberg, DL, Grossman, P., Kaufmann, PG, Malik, M., et al. (1997). Hjärtfrekvensvariation: ursprung, metoder och tolkningsförbehåll. Psykofysiologi 34, 623–648. doi: 10.1111 / j.1469-8986.1997.tb02140.x
Boonstra, E., de Kleijn, R., Colzato, LS, Alkemade, A., Forstmann, BU och Nieuwenhuis, S. (2015). Neurotransmittorer som kosttillskott: effekterna av GABA på hjärnan och beteendet. Främre. Psykol. 6: 1520. doi: 10.3389 / fpsyg.2015.01520
Bouche, N., Lacombe, B. och Fromm, H. (2003). GABA-signalering: en bevarad och allestädes närvarande mekanism. Trender Cell. Biol. 13, 607–610. doi: 10.1016 / j.tcb.2003.10.001
Byun, JI, Shin, YY, Chung, SE och Shin, WC (2018). Säkerhet och effekt av gamma-aminosmörsyra från fermenterad risgrodd hos patienter med sömnlöshetssymptom: en randomiserad, dubbelblind studie. J. Clin. Neurol. 14, 291–295. doi: 10.3988 / jcn.2018.14.3.291
Camm, AJ, Malik, M., Bigger, JT, Breithardt, G., Cerutti, S., Cohen, RJ, et al. (1996). Pulsvariation: mätstandarder, fysiologisk tolkning och klinisk användning. Cirkulation 93, 1043–1065. doi: 10.1161 / 01.CIR.93.5.1043
Carpenter, GH, Garrett, JR, Hartley, RH och Proctor, GB (1998). Påverkan av nerver på utsöndringen av immunglobulin A i submandibulär saliv hos råttor. J. Physiol . 512, 567–573. doi: 10.1111 / j.1469-7793.1998.567be.x
Cox, RC och Olatunji, BO (2016). En systematisk genomgång av sömnstörningar vid ångest och relaterade störningar. J. Angst Disord. 37, 104–129. doi: 10.1016 / j.janxdis.2015.12.001
Cryan, JF och Dinan, TG (2012). Sinnesförändrande mikroorganismer: inverkan av tarmmikrobioten på hjärnan och beteendet. Nat. Pastor Neurosci. 13, 701–712. doi: 10.1038 / nrn3346
DeWoskin, D., Myung, J., Belle, MD, Piggins, HD, Takumi, T. och Forger, DB (2015). Distinkta roller för GABA över flera tidsskalor vid dygnsdagsvis tidtagning. Proc. Natl. Acad. Sci. USA 112, E3911–3919. doi: 10.1073 / pnas.1420753112
Dhakal, R., Bajpai, VK och Baek, K.-H. (2012). Produktion av gaba (γ - aminosmörsyra) av mikroorganismer: en översyn. Braz. J. Microbiol. 43, 1230–1241. doi: 10.1590 / S1517-83822012000400001
Diana, M., Quílez, J. och Rafecas, M. (2014). Gamma-aminosmörsyra som en bioaktiv förening i livsmedel: en översyn. J. Funct. Livsmedel 10, 407–420. doi: 10.1016 / j.jff.2014.07.004
Dimsdale, JE, O'Connor, DT, Ziegler, M. och Mills, P. (1992). Kromogranin A korrelerar med noradrenalinfrisättningshastighet. Life Sci. 51, 519–525. doi: 10.1016 / 0024-3205 (92) 90029-O
Engeland, WC och Arnhold, MM (2005). Neurala kretsar vid reglering av binyrebarkens kortikosteronrytm. Endokrin 28, 325–332. doi: 10.1385 / ENDO: 28: 3: 325
Erdö, SL (1985). Perifera GABAergiska mekanismer. Trender Pharmacol. Sci. 6, 205–208. doi: 10.1016 / 0165-6147 (85) 90096-3
Fujibayashi, M., Kamiya, T., Takagaki, K. och Moritani, T. (2008). Aktivering av autonoma nervsystemets aktivitet genom oral intag av GABA. Nippon Eiyo Shokuryo Gakkaishi 61, 129–133. doi: 10.4327 / jsnfs.61.129
Gottesmann, C. (2002). GABA-mekanismer och sömn. Neurovetenskap 111, 231–239. doi: 10.1016 / S0306-4522 (02) 00034-9
Graham, NM, Bartholomeusz, RC, Taboonpong, N. och La Brooy, JT (1988). Minskar ångest utsöndringsgraden av sekretorisk IgA i saliv? Med. J. Austr. 148, 131–133. doi: 10.5694 / j.1326-5377.1988.tb112773.x
Higgins, JPT, Altman, DG, Gøtzsche, PC, Jüni, P., Moher, D., Oxman, AD, et al. (2011). Cochran-samarbetets verktyg för att bedöma risken för partiskhet i randomiserade studier. Br. Med. J. 343: d5928. doi: 10.1136 / bmj.d5928
Hinton, T., Jelinek, HF, Viengkhou, V., Johnston, GA och Matthews, S. (2019). Effekt av GABA-berikat oolongte på att minska stress i en universitetskohort. Främre. Nutr. 6:27. doi: 10.3389 / fnut.2019.00027
Jie, F., Yin, G., Yang, W., Yang, M., Gao, S., Lv, J., et al. (2018). Stress vid reglering av GABA-amygdala-systemet och relevans för neuropsykiatriska sjukdomar. Främre. Neurosci. 12: 562. doi: 10.3389 / fnins.2018.00562
Juneja, LR, Chu, D.-C., Okubo, T., Nagato, Y. och Yokogoshi, H. (1999). L-teanin - en unik aminosyra av grönt te och dess avslappningseffekt hos människor. Trender Mat Sci. Technol. 10, 199–204. doi: 10.1016 / S0924-2244 (99) 00044-8
Kanehira, T., Nakamura, Y., Nakamura, K., Horie, K., Horie, N., Furugori, K., et al. (2011). Att lindra yrkesmässig utmattning genom konsumtion av en dryck som innehåller gamma-aminosmörsyra. J. Nutr. Sci. Vitaminol. 57, 9–15. doi: 10.3177 / jnsv.57.9
Knudsen, GM, Poulsen, HE, och Paulson, OB (1988). Blod-hjärnbarriärpermeabilitet vid galaktosamininducerad leverencefalopati: inga bevis för ökad GABA-transport. J. Hepatol. 6, 187–192. doi: 10.1016 / S0168-8278 (88) 80030-8
Kuraishi, S. (2000). Utveckling av det "uchida-kraepelin psykodiagnostiska testet" i Japan. Psychologia 1, 104–109.
Kuriyama, K. och Sze, PY (1971). Blod-hjärnbarriär mot H3-y-aminosmörsyra i normala djur och aminooxiättiksyra-behandlade djur. Neurofarmakologi 10, 103–108. doi: 10.1016 / 0028-3908 (71) 90013-X
Li, H., Qiu, T., Huang, G. och Cao, Y. (2010). Produktion av gamma-aminosmörsyra med lactobacillus brevis NCL912 med användning av matad satsjäsning. Microb. Cellfakta. 9:85. doi: 10.1186 / 1475-2859-9-85
Liang, G., Xu, X., Zheng, Z., Xing, X. och Guo, J. (2019). EEG-signalindikator för emotionell reaktivitet, ” Paper presenterat vid den internationella konferensen om hjärninformatik (Haikou). doi: 10.1007 / 978-3-030-37078-7_1
Liao, W.-C., Wang, C.-Y., Shyu, Y.-T., Yu, R.-C. och Ho, K.-C. (2013). Inverkan av förbehandlingsmetoder och jäsning av adzukibönor på γ-aminosmörsyra (GABA) ackumulering av mjölksyrabakterier. J. Funct. Livsmedel 5, 1108–1115. doi: 10.1016 / j.jff.2013.03.006
Luppi, PH, Peyron, C. och Fort, P. (2017). Inte en enda men flera populationer av GABAergiska nervceller kontrollerar sömn. Sleep Med. Upp 32, 85–94. doi: 10.1016 / j.smrv.2016.03.002
Maskevich, S., Cassanet, A., Allen, NB, Trinder, J. och Bei, B. (2020). Sömn och stress hos ungdomar: rollen som upphetsning och hantering före sömnen under skolan och semestern. Sleep Med. 66, 130–138. doi: 10.1016 / j.sleep.2019.10.006
Moher, D., Shamseer, L., Clarke, M., Ghersi, D., Liberati, A., Petticrew, M., et al. (2015). Föredragna rapporteringspunkter för systematisk granskning och metaanalysprotokoll (PRISMA-P) 2015-uttalande. Syst. Upp 4: 1. doi: 10.1186 / 2046-4053-4-1
Nakamura, H., Takishima, T., Kometani, T. och Yokogoshi, H. (2009). Psykologisk stressreducerande effekt av choklad berikad med gamma-aminosmörsyra (GABA) hos människor: bedömning av stress med hjälp av hjärtfrekvensvariation och salivkromogranin A. Int. J. Food Sci. Nutr. 60, 106–113. doi: 10.1080 / 09637480802558508
Neckelmann, D., Mykletun, A. och Dahl, AA (2007). Kronisk sömnlöshet som en riskfaktor för att utveckla ångest och depression. Sov 30, 873–880. doi: 10.1093 / sleep / 30.7.873
Nemeroff, CB (2003). GABA: s roll i patofysiologin och behandlingen av ångeststörningar. Psykofarmakol. Tjur. 37, 133–146.
Nobre, AC, Rao, A. och Owen, GN (2008). L-teanin, en naturlig beståndsdel i te, och dess effekt på mentalt tillstånd. Asia Pacific J. Clin. Nutr. 17 (tillägg 1), 167–168.
Nuss, P. (2015). Ångeststörningar och GABA-neurotransmission: en störning av modulering. Neuropsykiatr. Dis. Behandla. 11, 165–175. doi: 10.2147 / NDT.S58841
Okada, T., Sugishita, T., Murakami, T., Murai, H., Saikusa, T., Horino, T., et al. (2000). Effekt av den avfettade risbakterien berikad med GABA för sömnlöshet, depression, autonom störning genom oral administrering. Nippon Shokuhin Kagaku Kogaku Kaishi 47, 596–603. doi: 10.3136 / nskkk.47.596
Okita, Y., Nakamura, H., Kouda, K., Takahashi, I., Takaoka, T., Kimura, M., et al. (2009). Effekter av grönsak som innehåller gamma-aminosmörsyra på hjärtets autonoma nervsystem hos friska unga människor. J Physiol. Antropol. 28, 101–107. doi: 10.2114 / jpa2.28.101
Olney, JW (1990). Excitotoxiska aminosyror och neuropsykiatriska störningar. Annu. Pastor Pharmacol. Toxicol. 30, 47–71. doi: 10.1146 / annurev.pa.30.040190.000403
Pagani, M., Mazzuero, G., Ferrari, A., Liberati, D., Cerutti, S., Vaitl, D., et al. (1991). Sympathovagal interaktion under mental stress. En studie med spektralanalys av hjärtfrekvensvariation hos friska kontrollpersoner och patienter med tidigare hjärtinfarkt. Cirkulation 83 (tillägg 4), 1143–1151.
Petroff, OA (2002). GABA och glutamat i människans hjärna. Neuroscientist 8, 562–573. doi: 10.1177 / 1073858402238515
Rashmi, D., Zanan, R., John, S., Khandagale, K. och Nadaf, A. (2018). Kapitel 13 - γ-aminosmörsyra (GABA): biosyntes, roll, kommersiell produktion och applikationer. Hingst. Nat. Produkter Chem. 57, 413–452. doi: 10.1016 / B978-0-444-64057-4.00013-2
Ray, W. och Cole, H. (1985). EEG alfa-aktivitet återspeglar uppmärksamhetskrav, och beta-aktivitet återspeglar emotionella och kognitiva processer. Vetenskap 228, 750–752. doi: 10.1126 / science.3992243
Riemann, D., Nissen, C., Palagini, L., Otte, A., Perlis, ML och Spiegelhalder, K. (2015). Neurobiologi, undersökning och behandling av kronisk sömnlöshet. Lancet Neurol. 14, 547–558. doi: 10.1016 / S1474-4422 (15) 00021-6
Roberts, E. (1974). γ-aminosmörsyra och nervsystemets funktion - Ett perspektiv. Biochem. Pharmacol. 23, 2637-2649. doi: 10.1016 / 0006-2952 (74) 90033-1
Roberts, E. och Eidelberg, E. (1960). Metaboliska och neurofysiologiska roller av gamma-aminosmörsyra. Int. Pastor Neurobiol. 2, 279–332. doi: 10.1016 / S0074-7742 (08) 60125-7
Roberts, E. och Frankel, S. (1950). gamma-aminosmörsyra i hjärnan: dess bildning av glutaminsyra. J. Biol. Chem. 187, 55–63.
Satya Narayan, V. och Nair, PM (1990). Metabolism, enzymologi och möjliga roller av 4-aminobutyrat i högre växter. Fytokemi 29, 367–375. doi: 10.1016 / 0031-9422 (90) 85081-P
Scholey, A., Downey, LA, Ciorciari, J., Pipingas, A., Nolidin, K., Finn, M., et al. (2012). Akuta neurokognitiva effekter av epigallocatechin gallate (EGCG). Aptit 58, 767–770. doi: 10.1016 / j.appet.2011.11.016
Schwartz, RD (1988). GABAa-receptorgaterade jonkanaler: biokemiska och farmakologiska studier av struktur och funktion. Biochem. Pharmacol. 37, 3369–3375. doi: 10.1016 / 0006-2952 (88) 90684-3
Shamseer, L., Moher, D., Clarke, M., Ghersi, D., Liberati, A., Petticrew, M., et al. (2015). Föredragna rapporteringsobjekt för systematisk granskning och metaanalysprotokoll (PRISMA-P) 2015: utarbetande och förklaring. Br. Med. J. 350: g7647. doi: 10.1136 / bmj.g7647
Shyamaladevi, N., Jayakumar, AR, Sujatha, R., Paul, V. och Subramanian, EH (2002). Bevis för att kväveoxidproduktion ökar gamma-aminosmörsyras permeabilitet i blod-hjärnbarriären. Brain Res. Tjur. 57, 231–236. doi: 10.1016 / S0361-9230 (01) 00755-9
Soehner, AM och Harvey, AG (2012). Förekomst och funktionella konsekvenser av allvarliga sömnlöshetssymptom vid humör och ångest: resultat från ett nationellt representativt urval. Sov 35, 1367–1375. doi: 10.5665 / sleep.2116
Steward, FC, Thompson, JF och Dent, CE (1949). γ-aminosmörsyra: en beståndsdel i potatisknölen? Vetenskap 110, 439–440.
Takanaga, H., Ohtsuki, S., Hosoya, K. och Terasaki, T. (2001). GAT2 / BGT-1 som ett system som ansvarar för transporten av gamma-aminosmörsyra vid musblod-hjärnbarriären. J. Cereb. Metab för blodflöde. 21, 1232–1239. doi: 10.1097 / 00004647-200110000-00012
Yamastsu, A., Yoneyama, M., Kim, M., Yamashita, Y., Horie, K., Yokogoshi, H., et al. (2015). De positiva effekterna av kaffe på stress och trötthet kan förbättras genom tillsats av GABA - En randomiserad, dubbelblind, placebokontrollerad, crossover-designad studie. Jpn. Pharmacol. Ther. 43, 515–519.
Yamatsu, A., Yamashita, Y., Horie, K., Takeshima, K., Horie, N., Masuda, K., et al. (2013). GABA: s gynnsamma verkan vid sömn och frekvent urinering på natten hos äldre. Jpn. Pharmacol. Ther. 41, 985–988.
Yamatsu, A., Yamashita, Y., Maru, I., Yang, J., Tatsuzaki, J. och Kim, M. (2015). Förbättring av sömn genom oralt intag av GABA och apocynum venetum leaf extract. J. Nutr. Sci. Vitaminol. 61, 182–187. doi: 10.3177 / jnsv.61.182
Yamatsu, A., Yamashita, Y., Pandharipande, T., Maru, I. och Kim, M. (2016). Effekt av oral gamma-aminosmörsyra (GABA) på sömn och dess absorption hos människor. Mat Sci. Bioteknik. 25, 547–551. doi: 10.1007 / s10068-016-0076-9
Yi Wen, T. och Mohd Aris, SA (2020). Elektroencefalogram (EEG) stressanalys på alfa / beta-förhållande och teta / beta-förhållande. Ind. J. Elect. Eng. Komp. Sci. 17: 175. doi: 10.11591 / ijeecs.v17.i1.pp175-182
Yoshida, S., Haramoto, M., Fukuda, T., Mizuno, H., Tanaka, A., Nishimura, M., et al. (2015). Optimering av en γ-aminosmörsyra (GABA) anrikningsprocess för vitt ris av hokkaido och effekterna av GABA-anrikat vitt ris på stressavlastning hos människor. Nippon Shokuhin Kagaku Kogaku Kaishi 62, 95–103. doi: 10.3136 / nskkk.62.95
Yoto, A., Murao, S., Motoki, M., Yokoyama, Y., Horie, N., Takeshima, K., et al. (2012). Oralt intag av γ-aminosmörsyra påverkar humör och aktiviteter i centrala nervsystemet under stressat tillstånd som orsakas av mentala uppgifter. Aminosyror 43, 1331–1337. doi: 10.1007 / s00726-011-1206-6
Nyckelord: gammaaminosmörsyra (GABA), stress, sömn, näringsämnen, kosttillskott
Citation: Hepsomali P, Groeger JA, Nishihira J och Scholey A (2020) Effekter av oral Gamma-aminosmörsyra (GABA) -administration på stress och sömn hos människor: En systematisk granskning. Främre. Neurosci. 14: 923. doi: 10.3389 / fnins.2020.00923
Mottagen: 7 maj 2020; Accepterat: 10 augusti 2020;
Publicerad: 17 september 2020.
Granskats av:
Daniela Calvetti , Case Western Reserve University, USAHercules Rezende Freitas , UC Davis MIND Institute, USA
Copyright © 2020 Hepsomali, Groeger, Nishihira och Scholey. Detta är en artikel med öppen tillgång som distribueras under villkoren i Creative Commons Attribution License (CC BY) . Användning, distribution eller reproduktion i andra forum är tillåten, förutsatt att den ursprungliga författaren (arna) och upphovsrättsinnehavaren (arna) krediteras och att den ursprungliga publikationen i denna tidskrift citeras, i enlighet med accepterad akademisk praxis. Ingen användning, distribution eller reproduktion är tillåten som inte uppfyller dessa villkor.
* Korrespondens: Piril Hepsomali, piril.hepsomali@unilever.com
- Unilever R&D, Bedford, Storbritannien
- 2 Institutionen för psykologi, School of Social Sciences, Nottingham Trent University, Nottingham, Storbritannien
- 3 Institutionen för medicinsk förvaltning och informatik, Hokkaido Information University, Hokkaido, Japan
- 4 Center for Human Psychopharmacology, School of Health Sciences, Swinburne University, Hawthorn, VIC, Australien
Gamma-aminosmörsyra (GABA) är en icke-proteinogen aminosyra och är den huvudsakliga hämmande neurotransmittorn i däggdjurshjärnan. GABAs stressreducerande och sömnförstärkande effekter har fastställts. Men även om flera kliniska prövningar på människa har genomförts, blandas resultaten avseende naturligt och / eller biosyntetiskt oralt GABA-intag på stress och sömn. Vi genomförde en systematisk granskning för att undersöka om naturligt och / eller biosyntetiskt oralt GABA-intag påverkar stress och sömn. Vi sökte systematiskt på PubMed-databasen efter studier publicerade fram till februari 2020 enligt PRISMA-riktlinjer. Endast placebokontrollerade humana prövningar som bedömde stress, sömn och relaterade psykofysiologiska resultat som ett svar på naturlig GABA (dvs. GABA som finns naturligt i livsmedel) eller biosyntetisk GABA (dvs. GABA som produceras via jäsning) intag ingick. Fjorton studier uppfyllde kriterierna och ingick i den systematiska granskningen. Även om det behövs fler studier innan några slutsatser kan göras om effekten av oral GABA-konsumtion på stress och sömn, visar resultaten att det finns begränsat bevis för stress och mycket begränsat bevis för sömnfördelar med oralt GABA-intag.
Introduktion
Gamma-aminosmörsyra (GABA) är en icke-proteinogen aminosyra med fyra kol som finns i bakterier, växter och ryggradsdjur. Ursprungligen upptäcktes det i växter ( Steward et al., 1949 ), det identifierades sedan i däggdjurshjärnan ( Roberts och Frankel, 1950 ) och därefter hos djur ( Roberts och Eidelberg, 1960 ) och flera andra organismer - inklusive bakterier och svampar ( Bouche et al., 2003 ). Hos ryggradsdjur genereras den av den irreversibla a-dekarboxyleringsreaktionen av L-glutaminsyra eller dess salter, katalyserad av glutaminsyradekarboxylasenzym ( Satya Narayan och Nair, 1990 ) och fungerar som en hämmande neurotransmittor i centrala nervsystemet (CNS) (Roberts och Frankel, 1950 ; Petroff, 2002 ), Det har också hittats i flera perifera vävnader ( Erdö, 1985 ). GABA är avgörande för CNS-funktionen, där ~ 60–75% av alla synapser är GABAergiska ( Schwartz, 1988 ).
Förutom sin roll som neurotransmittor finns GABA också naturligt i olika livsmedel, såsom te, tomat, sojabönor, grodd ris och vissa fermenterade livsmedel, och kan erhållas från en normal diet ( Diana et al., 2014 ; Rashmi et al., 2018 ). Till exempel innehåller vitt te och adzukibönor 0,5 respektive 2,01 g / kg GABA ( Zhao et al., 2011 ; Liao et al., 2013 ). Å andra sidan kan mycket högre koncentrationer av GABA produceras genom mjölksyrabakterier (LAB) fermentering ( Dhakal et al., 2012 ). Genom att till exempel använda Lactobacillus brevis NCL912-stam, kunde 103,5 g / l GABA produceras ( Li et al., 2010). Nyligen har LAB GABA fått betydande uppmärksamhet och har i stor utsträckning använts som en funktionell livsmedelsingrediens på olika marknader på grund av dess potentiella hälsofördelar associerade med GABA ( Boonstra et al., 2015 ).
Det är värt att nämna att GABA länge har ansetts vara oförmöget att korsa blod-hjärnbarriären (BBB) ( Kuriyama och Sze, 1971 ; Roberts, 1974 ), vilket väcker frågor om verkningsmekanismerna bakom dess hälsofördelar. Det finns dock olika konton angående GABA: s BBB-permeabilitet. Medan vissa forskare hävdar att endast små mängder GABA korsar BBB ( Knudsen et al., 1988 ; Bassett et al., 1990 ), med upptäckten av GABA-transportsystem i hjärnan (dvs. överföring av lösta ämnen genom transcytos, bärare -medierad transport, eller enkel diffusion av hydrofoba ämnen), andra tror att de betydande mängderna av GABA skulle kunna korsa BBB ( Takanaga et al., 2001 ;Al-Sarraf, 2002 ; Shyamaladevi et al., 2002 ). Eftersom GABA också är närvarande i det enteriska nervsystemet har man ansett att GABA kan verka på det perifera nervsystemet genom tarm-hjärnaxeln ( Cryan och Dinan, 2012 ). Även om det finns vissa bevis som visar att biosyntetisk GABA kan nå den mänskliga hjärnan, vilket framgår av olika EEG-svar ( Abdou et al., 2006 ; Yoto et al., 2012 ), hittills finns det inga data som visar GABA: s BBB-permeabilitet hos människor. Även om det har visats att GABA-nivåerna i blodet höjdes 30 minuter efter oralt GABA-intag ( Yamatsu et al., 2016 ), är det inte känt om oralt GABA-intag skulle öka GABA-koncentrationer i hjärnan eller inte.
Med tanke på den allestädes närvarande rollen som GABA som en hämmande neurotransmittor, tillsammans med dess utbredda distribution, är det inte förvånande att det har varit inblandat i ett stort antal beteenden ( Olney, 1990 ). Dessa inkluderar ångest- och stressreglering, dygnsrytm och sömnreglering, minnesförbättring, humör och till och med upplevelse av smärta ( Diana et al., 2014 ; Rashmi et al., 2018 ). Låga nivåer av GABA eller nedsatt GABA-funktion är associerad med etiologi och upprätthållande av akut och kronisk stress ( Jie et al., 2018 ), ångeststörningar ( Nemeroff, 2003 ) och sömnstörningar som sömnlöshet ( Gottesmann, 2002). Specifikt reglerar GABAergiska nervceller och neurotransmittorer hjärnkretsarna i (i) amygdala för att modulera stress och ångestsvar både under normala och patologiska förhållanden ( Nuss, 2015 ), (ii) kortikomedulära vägar för att modulera både snabb ögonrörelse (REM ) och icke-REM, särskilt långsam sömn (SWS) ( Luppi et al., 2017 ) och (iii) de suprachiasmatiska kärnorna (SCN) för att modulera dygnsrytmen ( DeWoskin et al., 2015 ). Allosteriska platser på GABAa-receptorerna tillåter också att nivån av hämning av nervceller i relevanta hjärnregioner regleras med hög noggrannhet, och dessa platser är de molekylära målen för både ångestdämpande och hypnotiska läkemedel ( Nuss, 2015 ; Riemann et al., 2015). Därför använder den farmakologiska behandlingen av ångeststörningar och sömnlöshet vanligtvis en bensodiazepinreceptoragonist som påverkar GABAergic transmission ( Nemeroff, 2003 ; Riemann et al., 2015 ) som verkar genom att öka bindningen av GABA till GABAa-receptorer för att förbättra hämmande signaler till cellgrupper som reglerar upphetsning. Detta resulterar i minskad stress och ångest, minskad sömnlatens och ökad sömnkontinuitet ( Gottesmann, 2002 ; Nemeroff, 2003 ; Nuss, 2015 ).
Medan ett begränsat antal mänskliga prövningar med ett brett spektrum av metoder (när det gäller dosen GABA, interventionens varaktighet och åtgärder som används för att bedöma stress och sömn) har undersökt effekten av icke-farmakologiska metoder för att minska stress och förbättra olika aspekter av sömn genom att använda naturligt och biosyntetiskt GABA-intag, så vitt vi vet har detta forskningsområde inte granskats systematiskt. Trots den höga metodologiska variationen i studierna som ingår i den aktuella granskningen är syftet med denna granskning att genomföra en systematisk granskning och bedöma robustheten i vetenskapliga bevis som stöder de positiva effekterna av oralt GABA (naturligt eller biosyntetiskt) intag på stress, sömn och relaterade psykofysiologiska åtgärder.
Metoder
Urval av studier
Inklusionskriterier
Inklusionskriterierna var följande:
• Resultatmått: stress, ångest, sömn och / eller relaterade psykofysiologiska parametrar
• Design: randomiserade kontrollerade studier och kvasi-experimentella studier
• Deltagare: Alla åldrar eller kön, friska eller ohälsosamma deltagare.
Exklusions kriterier
Uteslutningskriterierna var följande:
• Produkt: Syntetisk GABA (dvs. farmaceutiska ämnen)
• Design: Fallrapport, brev till redaktör, konferensbidrag, avhandling, personlig åsikt eller kommentar
• Djurstudier, in vitro- och ex vivo- studier.
Datakällor och sökstrategi
Vi genomförde en elektronisk litteratursökning på PubMed för att identifiera relevanta studier. Sökningen genomfördes fram till början av februari 2020. Söksträngarna som användes vid sökning var GABA OCH (stress ELLER sömn) INTE (gabapentin ELLER pregabalin). Artiklar valdes enligt föredragna rapporteringsartiklar för systematiska granskningar och metaanalyser (PRISMA) -diagrammet ( Moher et al., 2015 ; Shamseer et al., 2015 ). En granskare (PH) valde självständigt papper enligt ovannämnda kriterier för inkludering och uteslutning. Följande information extraherades från alla publikationer:
• Publikationsinformation : författare, år, tidskrift
• Deltagaregenskaper : antal rekryterade deltagare, antal deltagare som ingår i studien, antal deltagare (intervention), antal deltagare (kontroll), antal deltagare (annan intervention), hälsostatus, kön och åldersintervall
• Studiedesign : design och förblindning
• Interventionsegenskaper : interventionstid, tvättperiod, GABA-format, GABA-typ (naturlig eller biosyntetisk), GABA-dos, andra interventionstyper och doser
• Kontrollegenskaper : närvaro / frånvaro av kontroll / placebo, kontroll / placebodoser
• Resultatmått : frågeformulär för stress och sömn, kortisol, kromogranin A (CgA), immunglobulin A (IgA), adrenokortikotropiskt hormon (ACTH), adiponektin, hjärtfrekvens och hjärtfrekvensvariation, blodtryck, EEG-variabler
• Anmärkningar : anteckningar om de faktorer som kan påverka resultat / datakvalitet.
Studiekvaliteten bedömdes också med hjälp av Cochrane Collaborations verktyg för att bedöma risken för partiskhet i randomiserade studier ( Higgins et al., 2011 ).
Resultat
Vi identifierade 5 912 publikationer och screenade dem för att vara berättigade med hjälp av inkludering och uteslutningskriterier. Inledningsvis exkluderades 3 989 djurstudier, därefter ytterligare 10 in vitro- studier på människor. Ett tusen trehundra fyrtiosex studier som inte mätte stress och sömnrelaterade resultat exkluderades. Slutligen uteslöts 554 studier som inte undersökte konsumtionen av naturlig eller biosyntetisk GABA. Fjorton studier uppfyllde alla inklusionskriterier inkluderades i denna översyn ( figur 1 ).
En granskare (PH) utvärderade kvaliteten på de studier som ingår i denna granskning med hjälp av Cochrane Collaborations verktyg för att bedöma risken för partiskhet i randomiserade studier ( Higgins et al., 2011 ; Figur 2)). Majoriteten av studierna kategoriserades som med en oklar risk för selektionsbias, eftersom endast en av dem rapporterade metoden som användes för slumpmässig sekvensgenerering och allokeringsdöljning. Prestationsförskjutning, detektionsbias och förslitning observerades ha låg risk eftersom de flesta studierna var dubbelblinda och rapporterade alla resultaten. Risken för att rapportera bias var oklar eftersom vi inte var säkra på om forskare analyserade och rapporterade alla resultat som kunde extraheras från deras valda metoder. Slutligen fanns det en oklar fördom för potentiell intressekonflikt eftersom en eller flera författare till elva studier var anställda av ett industriföretag vid tidpunkten för publiceringen.
Sammanfattningar av alla studier presenteras i Tabell 1 (Metoder) och Tabell 2 (Resultat).
Effekten av GABA-konsumtion på stress
Två experimentella studier undersökte effekten av att konsumera GABA-berikade naturprodukter (som te och ris) på stress. Även om majoriteten av deltagargrupperna rapporterades vara friska varierade dosen GABA, interventionens varaktighet och de åtgärder som användes för att bedöma stress avsevärt.
En nyligen genomförd studie av Hinton et al. (2019) som undersökte de akuta effekterna av GABA Oolong-konsumtion på stress visade att både GABA Oolong-te (2,01 mg GABA / 200 ml te) och standard Oolong te (0,25 mg GABA / 200 ml te ) undersöktes ) ökat genomsnittligt RR-intervall (tiden mellan två på varandra följande R-vågor i elektrokardiogrammet). GABA Oolong hade emellertid ett större inflytande på hjärtfrekvensvariabilitet (HRV), vilket framkallade en större förändring i RR-intervallet hos höga jämfört med lågt stressade individer. Effekterna av GABA på andra HRV-parametrar och subjektiv stress var inte signifikanta. En annan studie av Yoshida et al. (2015)visade att 8 veckors konsumtion av GABA-ris (16,8 mg GABA i 150 g GABA-ris / dag) förbättrade den subjektiva lugn och oro i mitten av studien vid den fjärde behandlingsveckan jämfört med vitt ris (4,1 mg GABA i 150 g GABA-ris / dag) bibehölls dock inte dessa effekter. De rapporterade också trender för minskad blodkortisol och ökade adiponektinnivåer i tillståndet GABA-ris (mot vitt ris) vid den 8: e veckan av behandlingen. De observerade emellertid inga effekter på adrenokortikotropiskt hormon (ACTH) under något stadium av interventionen.
Alla de åtta experimentella studierna undersökte effekterna av (i) singel ( Abdou et al., 2006 ; Fujibayashi et al., 2008 ; Nakamura et al., 2009 ; Okita et al., 2009 ; Kanehira et al., 2011 ; Yoto et al., 2012 ; Yamastsu et al., 2015 ) och (ii) upprepade ( Yamatsu et al., 2013 ) biosyntetisk GABA-konsumtion på stress - främst på psykofysiologiska parametrar, med doser mellan 20-100 mg och deltagarnas antal mellan 7–63.
Fujibayashi et al. (2008) visade att 30 mg GABA-intag ökade (i) total effekt (TP) 30 och 60 minuter efter intag jämfört med baslinjen och (ii) högfrekvent effekt (HF) 30 min efter intag jämfört med baslinjen, men de misslyckades med att visa mellan gruppskillnader och skillnader i andra HRV-parametrar. Däremot Okita et al. (2009) rapporterade att placebotabletten ökade LF / HF-förhållandet och hjärtfrekvensen (HR) 20 och 40 minuter efter konsumtion. Denna ökning observerades inte i GABA-tillståndet (31,8 mg GABA), men de fann effekterna av GABA-konsumtion på andra parametrar inklusive strokevolym, hjärtutgång, HF- och LF-effekt, systoliskt blodtryck (SBP), diastoliskt blodtryck (DBP ) och genomsnittligt blodtryck (MBP). Använd elektroencefalografi (EEG), experiment 1 frånAbdou et al. (2006) visade att 100 mg GABA i 200 ml vatten ökade förändringar i (i) alfa-vågor (jämfört med vattentillstånd) och (ii) alfa / beta-förhållande (jämfört med vatten och teanintillstånd). De rapporterade också en trend för minskade förändringar för betavågor i GABA jämfört med vattenförhållanden. Den enda 4 veckors långa interventionsstudien med biosyntetisk GABA observerade en ökning av kortisolnivåerna i placebogruppen efter 2 och 4 veckors GABA-användning, men GABA-gruppen visade inte en sådan ökning ( Yamatsu et al., 2013 ).
De andra studierna använde olika metoder för att inducera stress hos deltagarna. Yamastsu et al. (2015) använde Uchida-Kraepelin Psychodiagnostic Test (UKT; Kuraishi, 2000 ), en aritmetisk uppgift för att inducera stress, och visade att 20 mg GABA i kaffe (jämfört med endast kaffe och vattenförhållanden) minskade kromogranin A (CgA) nivåer 30 min efter konsumtion. En liknande studie med användning av UKT- och CgA-nivåer ( Kanehira et al., 2011 ) visade att konsumtion av både 25 och 50 mg GABA i en 250 ml hypoton dryck (jämfört med endast hypotonisk dryck) sänkte salivcgA och kortisol hos individer med kronisk trötthet . Den subjektiva spänningen / ångestpoängen var dock inte signifikant. Nakamura et al. (2009)mätt både CgA och HRV och fann att 28 mg GABA i 10 g choklad, jämfört med 20 g choklad ensamt, minskade LF / HF-effekten 6,5-9,5 min efter den aritmetiska uppgiften (dvs = 36,5-39,5 min efter intag) HF-effekten 12–15 minuter efter den aritmetiska uppgiften (dvs. = 42–45 min efter intag). De rapporterade också att CgA-värdena ökade i chokladets enda tillstånd 30 och 50 minuter (jämfört med baslinjen) efter intag, en effekt som inte observerades i GABA-chokladtillstånd. Den elektrofysiologiska studien av Yoto et al. (2012)använde EEG för att visa att UKT minskade alfa- och beta-bandeffekten, medan 30 minuter efter ett 100 mg GABA-kapsel (vs. placebokapsel) intag hade denna minskning minskat. Även om deltagarna inte rapporterade en subjektiv ökning av avslappning och minskning av spännings / ångest och upphetsningspoäng. Till skillnad från studierna ovan, experiment 2 från Abdou et al. (2006) använde däremot en verklig stressuppgift där akrofoba deltagare ombads att korsa en upphängd bro. De upptäckte att kontrollgrupperna immunglobulin A (IgA) nivåer minskade i mitten och slutet av bron, men 100 mg GABA kapselgrupper IgA-nivåer visade inte detta mönster.
Effekten av GABA-konsumtion på sömn
Två åtta veckors interventionsstudier undersökte effekten av att konsumera GABA-berikat ris på sömnen hos friska individer. Yoshida et al. (2015) , som studerade friska medelålders individer med dålig sömn, fann en trend för förbättrade känslor vid uppvaknande i GABA-ris (16,8 mg GABA i 150 g GABA-ris / dag) (vs. vitt ris − 4,1 mg GABA i 150 g vitt ris / dag) grupp vid den fjärde interventionsveckan och efter två veckors intervention (dvs. vid den 10: e veckan). De fann ingen effekt av GABA-ris på VAS-sömnighetspoäng. Omvänt Okada et al. (2000)rapporterade hos postmenopausala kvinnor att konsumtionen av 26,4 mg GABA-ris 3 gånger om dagen (jämfört med kontrollris) förbättrade sömnlöshetspoängen för Kupperman klimakteriet vid den fjärde veckan av behandlingen. Dessutom undersökte endast en fyra veckors lång studie effekten av biosyntetisk GABA-konsumtion på sömn hos friska äldre deltagare. Med hjälp av OSA-sömninventariet visade de förbättringar i början och underhållet av sömn, sömnighet på morgonen och återhämtning från trötthetsvärden i GABA-gruppen efter 4 veckors behandling, även om de inte fann skillnader mellan GABA och placebogrupper ( Yamatsu et. al., 2013 ).
Tre interventionsstudier på 1 till 3 veckor (om än med mycket låga provstorlekar) undersökte effekterna av biosyntetisk GABA-konsumtion på sömn hos individer med dålig sömnkvalitet (en med PSQI> 5 målskyttar och två med PSQI> 6 målskyttar; PSQI : Pittsburgh Sleep Quality Index). I sin första 1 veckors långa interventionsstudie, Yamatsu et al. (2016)visade att intaget av 100 mg GABA-kapsel (kontra kontroll) förbättrade känslor vid uppvaknande, objektivt uppmätt minskad sömntid och ökad total sömntid för icke-REM (N1, N2 och N3 / SWS) efter ingrepp. De observerade också trender för förbättrad PSQI, sömntillfredsställelse och lättare att somna poäng och ökad ljus Icke-REM sömntid och sömneffektivitet i GABA (kontra kontroll) tillstånd efter behandling. De hittade emellertid inte signifikanta effekter för djup icke-REM (N3 / SWS) sömntid och tid (dvs varaktighet), REM-sömntid, uppvaknande frekvens eller delta vågkraft. I deras andra interventionsstudie på 1 vecka, Yamatsu et al. (2015), som studerade medelålders sovande som rapporterade att de hade dålig sömn, observerade en trend för minskad sömnfördröjning endast i 100 mg GABA kapsel (kontra kontroll) tillstånd. Resultat från PSQI-total, sömntillfredsställelse, känsla av att vakna, lätthet att somna poäng och icke-REM-sömntidsfördröjning, REM-sömntid, icke-REM-sömntid, uppvaknande frekvens och delta-vågkraft var inte signifikanta för GABA endast jämfört med annan intervention (AVLE och AVLE + GABA) och kontrollgrupper. Den senaste 4 veckor långa interventionsstudien på detta område av Byun et al. (2018), som studerade medelålders sovande som rapporterade att de hade dålig sömn rapporterade att intaget av 300 mg GABA-tablett (kontra kontrolltablett) minskade sömnstiden efter interventionen. De fann också att N2-sömn (%) och sömnlöshetsindex (ISI) minskade, liksom PSQI-total, PSQI-sömnkvalitet, PSQI-sömnlatens och PSQI-total sömntidspoäng i GABA-gruppen (före vs. efterbehandling) emellertid misslyckades de med att hitta skillnader mellan GABA och placebo / grupp. Dessutom fanns inga statistiskt signifikanta effekter av PSQI-sömneffektivitetspoäng och total sömntid, steg 1 och 3 Icke-REM-sömn (%), REM (%), vakna efter sömnstart (WASO; min), REM- sömnfördröjning, sömneffektivitet, upphetsningsindex, apné-hypopneaindex (AHI) och andningsbesvär (RDI).
Diskussion
Sammanfattning av de viktigaste resultaten
Denna systematiska granskning syftade till att fastställa den nuvarande statusen för kunskap om effekterna av naturlig och biosyntetisk GABA-konsumtion på stress och sömn. Sammantaget visade vår genomgång av litteraturen att det fanns låga till måttliga bevis för GABAs stress (på grund av att det finns fler studier med positiva resultat) och låga bevis för GABAs sömnfördelar.
Metoderna för studierna som ingår i denna översikt varierade signifikant men inkluderade både subjektiva och objektiva mått på stress och sömn. Majoriteten av studierna fann inte signifikanta subjektiva förbättringar av stresspoäng efter att ha konsumerat en enda dos av antingen naturliga eller biosyntetiska former av GABA. Bevis för utökad GABA-användning är blandad, Yoshida et al. (2015) studie som rapporterade förbättrad lugn och oro i GABA (vs. kontroll) -gruppen vid den fjärde behandlingsveckan, men inte med GABA-användning utöver det. Å andra sidan förbättrades bara några av de subjektiva sömnvärdena inklusive sömnstörningar, känslor vid uppvaknande, insättande och underhåll av sömn, sömnighet på morgonen och återhämtning från trötthetsresultat när det var en långvarig användning av GABA i minst en vecka (Okada et al., 2000 ; Yamatsu et al., 2013 , 2016 ). Återstående studier visade antingen trender mot förbättringar eller obetydlig subjektiv förbättring av sömnen. Det kan mycket väl vara så att långvarig naturlig användning av GABA krävs för att framkalla subjektiv stress och sömnfördelar.
Påfrestning
På grund av GABA: s BBB-permeabilitetsproblem använde de flesta studierna autonoma nervsystemet (ANS) -relaterade åtgärder (såsom HRV, kortisol och CgA) för att undersöka effekterna av GABA-konsumtion på stress. Abdou et al. (2006) och Yoto et al. (2012) använde EEG för att utvärdera den centrala effekten av GABA. Studierna med ANS-relaterade åtgärder visade positiva men ganska motstridiga resultat. Hinton et al. (2019) rapporterade ökade RR-intervall i GABA-tillståndet som återspeglar mer stabil ANS-funktion genom en ökning av vagal aktivitet (indikerar minskat stressrespons) ( Camm et al., 1996 ). På samma sätt, även om inga behandlingsskillnader rapporterades mellan GABA och kontrollförhållanden, Fujibayashi et al. (2008)visade en ökad TP i GABA-tillstånd 30 och 60 minuter efter intag (jämfört med baslinjen) vilket indikerar ANS-funktionalitet och anpassningsförmåga och minskad stress ( Camm et al., 1996 ). Samma studie rapporterade ökad HF i GABA-tillstånd 30 minuter efter intag (jämfört med baslinjen) vilket indikerar ökad PNS-aktivitet och minskad stress ( Berntson et al., 1997 ). Ökade RR-intervall, TP och HF antyder att GABA utövar sina effekter genom parasympatisk förstärkning utan eller mindre sympatiska effekter.
Resten av studierna som använde ANS-mått visade det motsatta aktiveringsmönstret. LF / HF, en markör för SNS-aktivitet och sympatovagal balans som ökar under stressförhållanden ( Pagani et al., 1991 ) ökade antingen inte ( Okita et al., 2009 ) eller reducerades i GABA-tillståndet ( Nakamura et al., 2009 ). På liknande sätt CgA, ett protein som frigörs tillsammans med noradrenalin i SNS ( Dimsdale et al., 1992 ) och kortisol, ett glukokortikoidhormon som frigörs av binjurebarken via (i) frisättning av adrenokortikotrop hormon genom reglering av hypotalamus-hypofysen - binjurexeln och (ii) SNS-innerveringen ( Engeland och Arnhold, 2005 ) reducerades i GABA kontra kontrollförhållanden (Nakamura et al., 2009 ; Kanehira et al., 2011 ; Yamastsu et al., 2015 ), vilket indikerar minskade stressnivåer. Dessutom befanns IgA, ett glykoprotein som regleras av SNS ( Carpenter et al., 1998 ) som är lägre i ångest ( Graham et al., 1988 ), minskat i kontroll men inte under GABA-förhållanden under en stressig uppgift. ( Abdou et al., 2006 ), vilket tyder på en stressskyddande effekt av GABA. Enligt dessa studier inducerade GABA avkoppling genom att modulera det sympatiska nervsystemet.
Även om det inte finns någon enighet om vilken uppdelning av det autonoma nervsystemet som påverkas mest av GABA-intaget, finns det begränsade bevis för att GABA också korsar BBB och utövar biologiska effekter på CNS. Stressreduktion och avkoppling är förknippade med förbättrade alfasvängningar ( Nobre et al., 2008 ), minskad betaaktivitet ( Ray och Cole, 1985 ) och ökat alfa / beta-förhållande ( Liang et al., 2019 ; Yi Wen och Mohd Aris, 2020 ). I linje med detta har Abdou et al. (2006) observerade ökade förändringar för alfa-vågor och alfa / beta-förhållande i GABA (vs. placebo) tillstånd, vilket tyder på förbättrad avkoppling. På samma sätt har Yoto et al. (2012)rapporterade att både alfa- och beta-vågor minskade på grund av en stressuppgift, men 30 minuter efter GABA-intag minskade denna minskning i GABA (kontra kontroll) tillstånd, vilket indikerar en stressskyddande effekt av GABA. Dessa resultat antyder att GABA passerar BBB antingen i små eller fulla mängder för att utöva biologiska effekter på CNS.
Sammanfattningsvis verkar stressmarkörer för båda divisionerna av ANS och CNS påverkas av oralt GABA-intag. Det är dock viktigt att notera att de effektiva doserna för stressreducerande och / eller stressskyddande fördelar varierar från 2,01 till 100 mg, där de lägre doserna upp till 30 mg verkar påverka de autonoma markörerna för stress och en dos på 100 mg. verkar påverka de centrala markörerna för stress. Dessutom verkar effektiva doser för naturlig GABA vara lägre än för biosyntetiska former. Även om naturligt GABA-intag och stressforskning är mycket begränsat kan dessa resultat också hänföras till de andra bioaktiva föreningarna som finns naturligt i livsmedel som har stressreducerande fördelar såsom l-theanin ( Juneja et al., 1999 ) och epigallocatechin gallate (EGCG) i te ( Scholey et al., 2012). Ytterligare studier är motiverade för att undersöka (i) naturlig och biosyntetisk GABA-biotillgänglighet hos människor efter oralt intag för att förstå GABAs verkningsmekanism för varje typ av GABA, (ii) minimala och optimala naturliga och biosyntetiska GABA-doser som krävs för stressfördelar, och (iii) minimala och optimala naturliga och biosyntetiska GABA-doser som krävs för att påverka stressreduktion / avslappning perifert och centralt.
Sömn
Det finns bara mycket begränsade stödjande bevis för rollen av oralt GABA-intag för objektiv sömnförbättring. Byun et al. (2018) , vars deltagare fick dos 1 timme innan de sov, rapporterade att användning av GABA under fyra veckor minskade sömnfördröjningen i GABA-gruppen (vs. kontroll). På liknande sätt har Yamatsu et al. (2016) , med dosering 30 minuter före sömn, visade att en veckas GABA-intervention minskade sömnstiden och ökade den totala sömntiden för icke-REM i GABA (kontra kontroll) tillstånd. I en tidigare studie med samma doseringsregim, Yamatsu et al. (2015)observerade endast en trend mot minskad sömnfördröjning efter 1 veckas GABA-konsumtion. Alla tre studierna misslyckades med att visa fördelaktiga effekter av GABA-intag på andra sömnmarkörer, såsom sömneffektivitet, REM-sömntid, uppvakningsfrekvens etc. Dessa resultat tyder på att långvarigt GABA-intag (dvs. upprepad dosering över dagar) kan vara fördelaktigt för naturligt inducerande sömn snarare än att upprätthålla sömn, eftersom bevis visade att GABA främst påverkar sömnstart och tidiga sömnstadier som inträffar tidigt på natten (dvs. nattens första icke-REM), men inte de sömnstadier som inträffar senare på natten. Detta kan förklaras av den farmakokinetiska profilen för GABA, som kännetecknas av en snabb ökning (30 minuter efter oral administrering) och sedan minskning (60 minuter efter oral administrering) i plasmakoncentrationer. Med andra ord, den snabba höjningen i blodet kan GABA-nivåerna förklara varför det påverkar differentiellt tidiga sömnmarkörer. Dessutom finns det ett dubbelriktat samband mellan sömn och både akut och kronisk ångest där sömnstörningar observeras hos individer med ångest (Soehner och Harvey, 2012 ) och sömnstörningar kan förutsäga utvecklingen av en ångestsyndrom ( Neckelmann et al., 2007 ). Specifikt har ökad latens för sömn observerats vid ångest och relaterade störningar ( Cox och Olatunji, 2016 ) och stress ( Maskevich et al., 2020 ). Därför kan fördelarna med tidigt sömnstadium med GABA-konsumtion förknippas med GABAs stressreducerande egenskaper snarare än direkt sömnframkallande och / eller upprätthållande av fördelar i sig.. Bristen på sömnunderhållsrelaterade fördelar med GABA kan också förklaras av (i) små och ojämna gruppstorlekar som maskerar verkliga förbättringar, (ii) otillräckliga GABA-mängder som inte driver SWS- och REM-svar och (iii) som inte använder split -natt PSG / EEG och maskering av de betydande förändringar som bara kan vara uppenbara i olika delar av natten.
Upprepat GABA-intag över dagar kan förbättra parametrarna för tidig sömn; Det är dock viktigt att notera att doser som krävs för att framkalla sömnfördelar (mellan 100 och 300 mg för biosyntetisk GABA) verkar vara högre än för stressfördelar (varierar mellan 20 och 100 mg för biosyntetisk och 2,01 och 26,4 mg för naturliga GABA) och verkar kräva en långvarig användning (1–8 veckor) för att bara förbättra tidiga sömnåtgärder. Med detta sagt verkar doser som sträcker sig mellan 100 och 300 mg vara effektiva för att minska sömnstiden med långvarig användning av 1–4 veckor. Återigen är det viktigt att notera att alla sömnstudier som rapporterade förbättrade objektiva sömnmått använde biosyntetiska former av GABA. Framtida forskning krävs för att förstå (i) de minimala och optimala naturliga och biosyntetiska GABA-doserna som krävs för att påverka olika sömnsteg,
Begränsningar
Den pågående översynen var föremål för flera begränsningar. För det första var kvaliteten på många av de granskade studierna tveksam på grund av potentiella intressekonflikter, lågt deltagande antal och ojämna kontroll- och interventionsgrupper. För det andra har inte alla studier bedömt samma stress- och / eller sömnparametrar eller använt samma design, varför ingen kvantitativ metaanalys kunde utföras på grund av heterogeniteten hos de extraherade data. För det tredje, även om PICOS (patientintervention-kontroll-utfall-studiedesign) användes för att extrahera data, fanns det bara en datautdragare och inget validerat verktyg har använts. Slutligen, på grund av det begränsade antalet heterogena studier inom detta område, kunde den exakta dosen för effektivitet för både stress- och sömnfördelar inte fastställas varken i den aktuella översynen eller i den allmänna vetenskapliga litteraturen. Därmed,
Slutsats
Denna översikt erbjuder en omfattande bedömning av den aktuella GABA-litteraturen och visar att naturligt och biosyntetiskt GABA-intag kan ha fördelaktiga effekter på stress och sömn. På grund av små provstorlekar och heterogenitet hos de använda metoderna är det dock nödvändigt med ytterligare forskning för att fastställa dostid, varaktighet och svarsförhållanden för både naturliga och biosyntetiska former av GABA för att på ett tillförlitligt sätt framkalla akut eller kronisk stress och sömneffekter.
Uttalande om datatillgänglighet
Alla datamängder som presenteras i denna studie ingår i artikeln.
Författarens bidrag
PH skrev manuskriptet med inmatning från JG, JN och AS som också bidragit till revisionen av manuskriptet kritiskt för viktigt intellektuellt innehåll. Alla författare bidrog till artikeln och godkände den inlämnade versionen.
Finansiering
Erhållna medel från Unilever UK Central Resources Limited för att täcka publiceringsavgifter för öppen tillgång.
Intressekonflikt
PH är anställd av Unilever UK Central Resources Limited. JG, JN och AS har fått forskningsfinansiering, konsulttjänster, resestöd och talaravgifter från olika industriföretag.
Referenser
Abdou, AM, Higashiguchi, S., Horie, K., Kim, M., Hatta, H. och Yokogoshi, H. (2006). Avslappnings- och immunförstärkningseffekter av gamma-aminosmörsyra (GABA) -administrering hos människor. Biofaktorer 26, 201–208. doi: 10.1002 / biof.5520260305
Al-Sarraf, H. (2002). Transport av 14C-gamma-aminosmörsyra till hjärnan, cerebrospinalvätska och koroid plexus hos nyfödda och vuxna råttor. Dev. Brain Res. 139, 121–129. doi: 10.1016 / S0165-3806 (02) 00537-0
Bassett, ML, Mullen, KD, Scholz, B., Fenstermacher, JD och Jones, EA (1990). Ökat hjärnupptag av γ-aminosmörsyra i en kaninmodell av leverencefalopati. Gastroenterologi 98, 747-757. doi: 10.1016 / 0016-5085 (90) 90298-F
Berntson, GG, Bigger, JT Jr, Eckberg, DL, Grossman, P., Kaufmann, PG, Malik, M., et al. (1997). Hjärtfrekvensvariation: ursprung, metoder och tolkningsförbehåll. Psykofysiologi 34, 623–648. doi: 10.1111 / j.1469-8986.1997.tb02140.x
Boonstra, E., de Kleijn, R., Colzato, LS, Alkemade, A., Forstmann, BU och Nieuwenhuis, S. (2015). Neurotransmittorer som kosttillskott: effekterna av GABA på hjärnan och beteendet. Främre. Psykol. 6: 1520. doi: 10.3389 / fpsyg.2015.01520
Bouche, N., Lacombe, B. och Fromm, H. (2003). GABA-signalering: en bevarad och allestädes närvarande mekanism. Trender Cell. Biol. 13, 607–610. doi: 10.1016 / j.tcb.2003.10.001
Byun, JI, Shin, YY, Chung, SE och Shin, WC (2018). Säkerhet och effekt av gamma-aminosmörsyra från fermenterad risgrodd hos patienter med sömnlöshetssymptom: en randomiserad, dubbelblind studie. J. Clin. Neurol. 14, 291–295. doi: 10.3988 / jcn.2018.14.3.291
Camm, AJ, Malik, M., Bigger, JT, Breithardt, G., Cerutti, S., Cohen, RJ, et al. (1996). Pulsvariation: mätstandarder, fysiologisk tolkning och klinisk användning. Cirkulation 93, 1043–1065. doi: 10.1161 / 01.CIR.93.5.1043
Carpenter, GH, Garrett, JR, Hartley, RH och Proctor, GB (1998). Påverkan av nerver på utsöndringen av immunglobulin A i submandibulär saliv hos råttor. J. Physiol . 512, 567–573. doi: 10.1111 / j.1469-7793.1998.567be.x
Cox, RC och Olatunji, BO (2016). En systematisk genomgång av sömnstörningar vid ångest och relaterade störningar. J. Angst Disord. 37, 104–129. doi: 10.1016 / j.janxdis.2015.12.001
Cryan, JF och Dinan, TG (2012). Sinnesförändrande mikroorganismer: inverkan av tarmmikrobioten på hjärnan och beteendet. Nat. Pastor Neurosci. 13, 701–712. doi: 10.1038 / nrn3346
DeWoskin, D., Myung, J., Belle, MD, Piggins, HD, Takumi, T. och Forger, DB (2015). Distinkta roller för GABA över flera tidsskalor vid dygnsdagsvis tidtagning. Proc. Natl. Acad. Sci. USA 112, E3911–3919. doi: 10.1073 / pnas.1420753112
Dhakal, R., Bajpai, VK och Baek, K.-H. (2012). Produktion av gaba (γ - aminosmörsyra) av mikroorganismer: en översyn. Braz. J. Microbiol. 43, 1230–1241. doi: 10.1590 / S1517-83822012000400001
Diana, M., Quílez, J. och Rafecas, M. (2014). Gamma-aminosmörsyra som en bioaktiv förening i livsmedel: en översyn. J. Funct. Livsmedel 10, 407–420. doi: 10.1016 / j.jff.2014.07.004
Dimsdale, JE, O'Connor, DT, Ziegler, M. och Mills, P. (1992). Kromogranin A korrelerar med noradrenalinfrisättningshastighet. Life Sci. 51, 519–525. doi: 10.1016 / 0024-3205 (92) 90029-O
Engeland, WC och Arnhold, MM (2005). Neurala kretsar vid reglering av binyrebarkens kortikosteronrytm. Endokrin 28, 325–332. doi: 10.1385 / ENDO: 28: 3: 325
Erdö, SL (1985). Perifera GABAergiska mekanismer. Trender Pharmacol. Sci. 6, 205–208. doi: 10.1016 / 0165-6147 (85) 90096-3
Fujibayashi, M., Kamiya, T., Takagaki, K. och Moritani, T. (2008). Aktivering av autonoma nervsystemets aktivitet genom oral intag av GABA. Nippon Eiyo Shokuryo Gakkaishi 61, 129–133. doi: 10.4327 / jsnfs.61.129
Gottesmann, C. (2002). GABA-mekanismer och sömn. Neurovetenskap 111, 231–239. doi: 10.1016 / S0306-4522 (02) 00034-9
Graham, NM, Bartholomeusz, RC, Taboonpong, N. och La Brooy, JT (1988). Minskar ångest utsöndringsgraden av sekretorisk IgA i saliv? Med. J. Austr. 148, 131–133. doi: 10.5694 / j.1326-5377.1988.tb112773.x
Higgins, JPT, Altman, DG, Gøtzsche, PC, Jüni, P., Moher, D., Oxman, AD, et al. (2011). Cochran-samarbetets verktyg för att bedöma risken för partiskhet i randomiserade studier. Br. Med. J. 343: d5928. doi: 10.1136 / bmj.d5928
Hinton, T., Jelinek, HF, Viengkhou, V., Johnston, GA och Matthews, S. (2019). Effekt av GABA-berikat oolongte på att minska stress i en universitetskohort. Främre. Nutr. 6:27. doi: 10.3389 / fnut.2019.00027
Jie, F., Yin, G., Yang, W., Yang, M., Gao, S., Lv, J., et al. (2018). Stress vid reglering av GABA-amygdala-systemet och relevans för neuropsykiatriska sjukdomar. Främre. Neurosci. 12: 562. doi: 10.3389 / fnins.2018.00562
Juneja, LR, Chu, D.-C., Okubo, T., Nagato, Y. och Yokogoshi, H. (1999). L-teanin - en unik aminosyra av grönt te och dess avslappningseffekt hos människor. Trender Mat Sci. Technol. 10, 199–204. doi: 10.1016 / S0924-2244 (99) 00044-8
Kanehira, T., Nakamura, Y., Nakamura, K., Horie, K., Horie, N., Furugori, K., et al. (2011). Att lindra yrkesmässig utmattning genom konsumtion av en dryck som innehåller gamma-aminosmörsyra. J. Nutr. Sci. Vitaminol. 57, 9–15. doi: 10.3177 / jnsv.57.9
Knudsen, GM, Poulsen, HE, och Paulson, OB (1988). Blod-hjärnbarriärpermeabilitet vid galaktosamininducerad leverencefalopati: inga bevis för ökad GABA-transport. J. Hepatol. 6, 187–192. doi: 10.1016 / S0168-8278 (88) 80030-8
Kuraishi, S. (2000). Utveckling av det "uchida-kraepelin psykodiagnostiska testet" i Japan. Psychologia 1, 104–109.
Kuriyama, K. och Sze, PY (1971). Blod-hjärnbarriär mot H3-y-aminosmörsyra i normala djur och aminooxiättiksyra-behandlade djur. Neurofarmakologi 10, 103–108. doi: 10.1016 / 0028-3908 (71) 90013-X
Li, H., Qiu, T., Huang, G. och Cao, Y. (2010). Produktion av gamma-aminosmörsyra med lactobacillus brevis NCL912 med användning av matad satsjäsning. Microb. Cellfakta. 9:85. doi: 10.1186 / 1475-2859-9-85
Liang, G., Xu, X., Zheng, Z., Xing, X. och Guo, J. (2019). EEG-signalindikator för emotionell reaktivitet, ” Paper presenterat vid den internationella konferensen om hjärninformatik (Haikou). doi: 10.1007 / 978-3-030-37078-7_1
Liao, W.-C., Wang, C.-Y., Shyu, Y.-T., Yu, R.-C. och Ho, K.-C. (2013). Inverkan av förbehandlingsmetoder och jäsning av adzukibönor på γ-aminosmörsyra (GABA) ackumulering av mjölksyrabakterier. J. Funct. Livsmedel 5, 1108–1115. doi: 10.1016 / j.jff.2013.03.006
Luppi, PH, Peyron, C. och Fort, P. (2017). Inte en enda men flera populationer av GABAergiska nervceller kontrollerar sömn. Sleep Med. Upp 32, 85–94. doi: 10.1016 / j.smrv.2016.03.002
Maskevich, S., Cassanet, A., Allen, NB, Trinder, J. och Bei, B. (2020). Sömn och stress hos ungdomar: rollen som upphetsning och hantering före sömnen under skolan och semestern. Sleep Med. 66, 130–138. doi: 10.1016 / j.sleep.2019.10.006
Moher, D., Shamseer, L., Clarke, M., Ghersi, D., Liberati, A., Petticrew, M., et al. (2015). Föredragna rapporteringspunkter för systematisk granskning och metaanalysprotokoll (PRISMA-P) 2015-uttalande. Syst. Upp 4: 1. doi: 10.1186 / 2046-4053-4-1
Nakamura, H., Takishima, T., Kometani, T. och Yokogoshi, H. (2009). Psykologisk stressreducerande effekt av choklad berikad med gamma-aminosmörsyra (GABA) hos människor: bedömning av stress med hjälp av hjärtfrekvensvariation och salivkromogranin A. Int. J. Food Sci. Nutr. 60, 106–113. doi: 10.1080 / 09637480802558508
Neckelmann, D., Mykletun, A. och Dahl, AA (2007). Kronisk sömnlöshet som en riskfaktor för att utveckla ångest och depression. Sov 30, 873–880. doi: 10.1093 / sleep / 30.7.873
Nemeroff, CB (2003). GABA: s roll i patofysiologin och behandlingen av ångeststörningar. Psykofarmakol. Tjur. 37, 133–146.
Nobre, AC, Rao, A. och Owen, GN (2008). L-teanin, en naturlig beståndsdel i te, och dess effekt på mentalt tillstånd. Asia Pacific J. Clin. Nutr. 17 (tillägg 1), 167–168.
Nuss, P. (2015). Ångeststörningar och GABA-neurotransmission: en störning av modulering. Neuropsykiatr. Dis. Behandla. 11, 165–175. doi: 10.2147 / NDT.S58841
Okada, T., Sugishita, T., Murakami, T., Murai, H., Saikusa, T., Horino, T., et al. (2000). Effekt av den avfettade risbakterien berikad med GABA för sömnlöshet, depression, autonom störning genom oral administrering. Nippon Shokuhin Kagaku Kogaku Kaishi 47, 596–603. doi: 10.3136 / nskkk.47.596
Okita, Y., Nakamura, H., Kouda, K., Takahashi, I., Takaoka, T., Kimura, M., et al. (2009). Effekter av grönsak som innehåller gamma-aminosmörsyra på hjärtets autonoma nervsystem hos friska unga människor. J Physiol. Antropol. 28, 101–107. doi: 10.2114 / jpa2.28.101
Olney, JW (1990). Excitotoxiska aminosyror och neuropsykiatriska störningar. Annu. Pastor Pharmacol. Toxicol. 30, 47–71. doi: 10.1146 / annurev.pa.30.040190.000403
Pagani, M., Mazzuero, G., Ferrari, A., Liberati, D., Cerutti, S., Vaitl, D., et al. (1991). Sympathovagal interaktion under mental stress. En studie med spektralanalys av hjärtfrekvensvariation hos friska kontrollpersoner och patienter med tidigare hjärtinfarkt. Cirkulation 83 (tillägg 4), 1143–1151.
Petroff, OA (2002). GABA och glutamat i människans hjärna. Neuroscientist 8, 562–573. doi: 10.1177 / 1073858402238515
Rashmi, D., Zanan, R., John, S., Khandagale, K. och Nadaf, A. (2018). Kapitel 13 - γ-aminosmörsyra (GABA): biosyntes, roll, kommersiell produktion och applikationer. Hingst. Nat. Produkter Chem. 57, 413–452. doi: 10.1016 / B978-0-444-64057-4.00013-2
Ray, W. och Cole, H. (1985). EEG alfa-aktivitet återspeglar uppmärksamhetskrav, och beta-aktivitet återspeglar emotionella och kognitiva processer. Vetenskap 228, 750–752. doi: 10.1126 / science.3992243
Riemann, D., Nissen, C., Palagini, L., Otte, A., Perlis, ML och Spiegelhalder, K. (2015). Neurobiologi, undersökning och behandling av kronisk sömnlöshet. Lancet Neurol. 14, 547–558. doi: 10.1016 / S1474-4422 (15) 00021-6
Roberts, E. (1974). γ-aminosmörsyra och nervsystemets funktion - Ett perspektiv. Biochem. Pharmacol. 23, 2637-2649. doi: 10.1016 / 0006-2952 (74) 90033-1
Roberts, E. och Eidelberg, E. (1960). Metaboliska och neurofysiologiska roller av gamma-aminosmörsyra. Int. Pastor Neurobiol. 2, 279–332. doi: 10.1016 / S0074-7742 (08) 60125-7
Roberts, E. och Frankel, S. (1950). gamma-aminosmörsyra i hjärnan: dess bildning av glutaminsyra. J. Biol. Chem. 187, 55–63.
Satya Narayan, V. och Nair, PM (1990). Metabolism, enzymologi och möjliga roller av 4-aminobutyrat i högre växter. Fytokemi 29, 367–375. doi: 10.1016 / 0031-9422 (90) 85081-P
Scholey, A., Downey, LA, Ciorciari, J., Pipingas, A., Nolidin, K., Finn, M., et al. (2012). Akuta neurokognitiva effekter av epigallocatechin gallate (EGCG). Aptit 58, 767–770. doi: 10.1016 / j.appet.2011.11.016
Schwartz, RD (1988). GABAa-receptorgaterade jonkanaler: biokemiska och farmakologiska studier av struktur och funktion. Biochem. Pharmacol. 37, 3369–3375. doi: 10.1016 / 0006-2952 (88) 90684-3
Shamseer, L., Moher, D., Clarke, M., Ghersi, D., Liberati, A., Petticrew, M., et al. (2015). Föredragna rapporteringsobjekt för systematisk granskning och metaanalysprotokoll (PRISMA-P) 2015: utarbetande och förklaring. Br. Med. J. 350: g7647. doi: 10.1136 / bmj.g7647
Shyamaladevi, N., Jayakumar, AR, Sujatha, R., Paul, V. och Subramanian, EH (2002). Bevis för att kväveoxidproduktion ökar gamma-aminosmörsyras permeabilitet i blod-hjärnbarriären. Brain Res. Tjur. 57, 231–236. doi: 10.1016 / S0361-9230 (01) 00755-9
Soehner, AM och Harvey, AG (2012). Förekomst och funktionella konsekvenser av allvarliga sömnlöshetssymptom vid humör och ångest: resultat från ett nationellt representativt urval. Sov 35, 1367–1375. doi: 10.5665 / sleep.2116
Steward, FC, Thompson, JF och Dent, CE (1949). γ-aminosmörsyra: en beståndsdel i potatisknölen? Vetenskap 110, 439–440.
Takanaga, H., Ohtsuki, S., Hosoya, K. och Terasaki, T. (2001). GAT2 / BGT-1 som ett system som ansvarar för transporten av gamma-aminosmörsyra vid musblod-hjärnbarriären. J. Cereb. Metab för blodflöde. 21, 1232–1239. doi: 10.1097 / 00004647-200110000-00012
Yamastsu, A., Yoneyama, M., Kim, M., Yamashita, Y., Horie, K., Yokogoshi, H., et al. (2015). De positiva effekterna av kaffe på stress och trötthet kan förbättras genom tillsats av GABA - En randomiserad, dubbelblind, placebokontrollerad, crossover-designad studie. Jpn. Pharmacol. Ther. 43, 515–519.
Yamatsu, A., Yamashita, Y., Horie, K., Takeshima, K., Horie, N., Masuda, K., et al. (2013). GABA: s gynnsamma verkan vid sömn och frekvent urinering på natten hos äldre. Jpn. Pharmacol. Ther. 41, 985–988.
Yamatsu, A., Yamashita, Y., Maru, I., Yang, J., Tatsuzaki, J. och Kim, M. (2015). Förbättring av sömn genom oralt intag av GABA och apocynum venetum leaf extract. J. Nutr. Sci. Vitaminol. 61, 182–187. doi: 10.3177 / jnsv.61.182
Yamatsu, A., Yamashita, Y., Pandharipande, T., Maru, I. och Kim, M. (2016). Effekt av oral gamma-aminosmörsyra (GABA) på sömn och dess absorption hos människor. Mat Sci. Bioteknik. 25, 547–551. doi: 10.1007 / s10068-016-0076-9
Yi Wen, T. och Mohd Aris, SA (2020). Elektroencefalogram (EEG) stressanalys på alfa / beta-förhållande och teta / beta-förhållande. Ind. J. Elect. Eng. Komp. Sci. 17: 175. doi: 10.11591 / ijeecs.v17.i1.pp175-182
Yoshida, S., Haramoto, M., Fukuda, T., Mizuno, H., Tanaka, A., Nishimura, M., et al. (2015). Optimering av en γ-aminosmörsyra (GABA) anrikningsprocess för vitt ris av hokkaido och effekterna av GABA-anrikat vitt ris på stressavlastning hos människor. Nippon Shokuhin Kagaku Kogaku Kaishi 62, 95–103. doi: 10.3136 / nskkk.62.95
Yoto, A., Murao, S., Motoki, M., Yokoyama, Y., Horie, N., Takeshima, K., et al. (2012). Oralt intag av γ-aminosmörsyra påverkar humör och aktiviteter i centrala nervsystemet under stressat tillstånd som orsakas av mentala uppgifter. Aminosyror 43, 1331–1337. doi: 10.1007 / s00726-011-1206-6
Nyckelord: gammaaminosmörsyra (GABA), stress, sömn, näringsämnen, kosttillskott
Citation: Hepsomali P, Groeger JA, Nishihira J och Scholey A (2020) Effekter av oral Gamma-aminosmörsyra (GABA) -administration på stress och sömn hos människor: En systematisk granskning. Främre. Neurosci. 14: 923. doi: 10.3389 / fnins.2020.00923
Mottagen: 7 maj 2020; Accepterat: 10 augusti 2020;
Publicerad: 17 september 2020.
Granskats av:
Daniela Calvetti , Case Western Reserve University, USAHercules Rezende Freitas , UC Davis MIND Institute, USA
Copyright © 2020 Hepsomali, Groeger, Nishihira och Scholey. Detta är en artikel med öppen tillgång som distribueras under villkoren i Creative Commons Attribution License (CC BY) . Användning, distribution eller reproduktion i andra forum är tillåten, förutsatt att den ursprungliga författaren (arna) och upphovsrättsinnehavaren (arna) krediteras och att den ursprungliga publikationen i denna tidskrift citeras, i enlighet med accepterad akademisk praxis. Ingen användning, distribution eller reproduktion är tillåten som inte uppfyller dessa villkor.
* Korrespondens: Piril Hepsomali, piril.hepsomali@unilever.com
- Unilever R&D, Bedford, Storbritannien
- 2 Institutionen för psykologi, School of Social Sciences, Nottingham Trent University, Nottingham, Storbritannien
- 3 Institutionen för medicinsk förvaltning och informatik, Hokkaido Information University, Hokkaido, Japan
- 4 Center for Human Psychopharmacology, School of Health Sciences, Swinburne University, Hawthorn, VIC, Australien
Gamma-aminosmörsyra (GABA) är en icke-proteinogen aminosyra och är den huvudsakliga hämmande neurotransmittorn i däggdjurshjärnan. GABAs stressreducerande och sömnförstärkande effekter har fastställts. Men även om flera kliniska prövningar på människa har genomförts, blandas resultaten avseende naturligt och / eller biosyntetiskt oralt GABA-intag på stress och sömn. Vi genomförde en systematisk granskning för att undersöka om naturligt och / eller biosyntetiskt oralt GABA-intag påverkar stress och sömn. Vi sökte systematiskt på PubMed-databasen efter studier publicerade fram till februari 2020 enligt PRISMA-riktlinjer. Endast placebokontrollerade humana prövningar som bedömde stress, sömn och relaterade psykofysiologiska resultat som ett svar på naturlig GABA (dvs. GABA som finns naturligt i livsmedel) eller biosyntetisk GABA (dvs. GABA som produceras via jäsning) intag ingick. Fjorton studier uppfyllde kriterierna och ingick i den systematiska granskningen. Även om det behövs fler studier innan några slutsatser kan göras om effekten av oral GABA-konsumtion på stress och sömn, visar resultaten att det finns begränsat bevis för stress och mycket begränsat bevis för sömnfördelar med oralt GABA-intag.
Introduktion
Gamma-aminosmörsyra (GABA) är en icke-proteinogen aminosyra med fyra kol som finns i bakterier, växter och ryggradsdjur. Ursprungligen upptäcktes det i växter ( Steward et al., 1949 ), det identifierades sedan i däggdjurshjärnan ( Roberts och Frankel, 1950 ) och därefter hos djur ( Roberts och Eidelberg, 1960 ) och flera andra organismer - inklusive bakterier och svampar ( Bouche et al., 2003 ). Hos ryggradsdjur genereras den av den irreversibla a-dekarboxyleringsreaktionen av L-glutaminsyra eller dess salter, katalyserad av glutaminsyradekarboxylasenzym ( Satya Narayan och Nair, 1990 ) och fungerar som en hämmande neurotransmittor i centrala nervsystemet (CNS) (Roberts och Frankel, 1950 ; Petroff, 2002 ), Det har också hittats i flera perifera vävnader ( Erdö, 1985 ). GABA är avgörande för CNS-funktionen, där ~ 60–75% av alla synapser är GABAergiska ( Schwartz, 1988 ).
Förutom sin roll som neurotransmittor finns GABA också naturligt i olika livsmedel, såsom te, tomat, sojabönor, grodd ris och vissa fermenterade livsmedel, och kan erhållas från en normal diet ( Diana et al., 2014 ; Rashmi et al., 2018 ). Till exempel innehåller vitt te och adzukibönor 0,5 respektive 2,01 g / kg GABA ( Zhao et al., 2011 ; Liao et al., 2013 ). Å andra sidan kan mycket högre koncentrationer av GABA produceras genom mjölksyrabakterier (LAB) fermentering ( Dhakal et al., 2012 ). Genom att till exempel använda Lactobacillus brevis NCL912-stam, kunde 103,5 g / l GABA produceras ( Li et al., 2010). Nyligen har LAB GABA fått betydande uppmärksamhet och har i stor utsträckning använts som en funktionell livsmedelsingrediens på olika marknader på grund av dess potentiella hälsofördelar associerade med GABA ( Boonstra et al., 2015 ).
Det är värt att nämna att GABA länge har ansetts vara oförmöget att korsa blod-hjärnbarriären (BBB) ( Kuriyama och Sze, 1971 ; Roberts, 1974 ), vilket väcker frågor om verkningsmekanismerna bakom dess hälsofördelar. Det finns dock olika konton angående GABA: s BBB-permeabilitet. Medan vissa forskare hävdar att endast små mängder GABA korsar BBB ( Knudsen et al., 1988 ; Bassett et al., 1990 ), med upptäckten av GABA-transportsystem i hjärnan (dvs. överföring av lösta ämnen genom transcytos, bärare -medierad transport, eller enkel diffusion av hydrofoba ämnen), andra tror att de betydande mängderna av GABA skulle kunna korsa BBB ( Takanaga et al., 2001 ;Al-Sarraf, 2002 ; Shyamaladevi et al., 2002 ). Eftersom GABA också är närvarande i det enteriska nervsystemet har man ansett att GABA kan verka på det perifera nervsystemet genom tarm-hjärnaxeln ( Cryan och Dinan, 2012 ). Även om det finns vissa bevis som visar att biosyntetisk GABA kan nå den mänskliga hjärnan, vilket framgår av olika EEG-svar ( Abdou et al., 2006 ; Yoto et al., 2012 ), hittills finns det inga data som visar GABA: s BBB-permeabilitet hos människor. Även om det har visats att GABA-nivåerna i blodet höjdes 30 minuter efter oralt GABA-intag ( Yamatsu et al., 2016 ), är det inte känt om oralt GABA-intag skulle öka GABA-koncentrationer i hjärnan eller inte.
Med tanke på den allestädes närvarande rollen som GABA som en hämmande neurotransmittor, tillsammans med dess utbredda distribution, är det inte förvånande att det har varit inblandat i ett stort antal beteenden ( Olney, 1990 ). Dessa inkluderar ångest- och stressreglering, dygnsrytm och sömnreglering, minnesförbättring, humör och till och med upplevelse av smärta ( Diana et al., 2014 ; Rashmi et al., 2018 ). Låga nivåer av GABA eller nedsatt GABA-funktion är associerad med etiologi och upprätthållande av akut och kronisk stress ( Jie et al., 2018 ), ångeststörningar ( Nemeroff, 2003 ) och sömnstörningar som sömnlöshet ( Gottesmann, 2002). Specifikt reglerar GABAergiska nervceller och neurotransmittorer hjärnkretsarna i (i) amygdala för att modulera stress och ångestsvar både under normala och patologiska förhållanden ( Nuss, 2015 ), (ii) kortikomedulära vägar för att modulera både snabb ögonrörelse (REM ) och icke-REM, särskilt långsam sömn (SWS) ( Luppi et al., 2017 ) och (iii) de suprachiasmatiska kärnorna (SCN) för att modulera dygnsrytmen ( DeWoskin et al., 2015 ). Allosteriska platser på GABAa-receptorerna tillåter också att nivån av hämning av nervceller i relevanta hjärnregioner regleras med hög noggrannhet, och dessa platser är de molekylära målen för både ångestdämpande och hypnotiska läkemedel ( Nuss, 2015 ; Riemann et al., 2015). Därför använder den farmakologiska behandlingen av ångeststörningar och sömnlöshet vanligtvis en bensodiazepinreceptoragonist som påverkar GABAergic transmission ( Nemeroff, 2003 ; Riemann et al., 2015 ) som verkar genom att öka bindningen av GABA till GABAa-receptorer för att förbättra hämmande signaler till cellgrupper som reglerar upphetsning. Detta resulterar i minskad stress och ångest, minskad sömnlatens och ökad sömnkontinuitet ( Gottesmann, 2002 ; Nemeroff, 2003 ; Nuss, 2015 ).
Medan ett begränsat antal mänskliga prövningar med ett brett spektrum av metoder (när det gäller dosen GABA, interventionens varaktighet och åtgärder som används för att bedöma stress och sömn) har undersökt effekten av icke-farmakologiska metoder för att minska stress och förbättra olika aspekter av sömn genom att använda naturligt och biosyntetiskt GABA-intag, så vitt vi vet har detta forskningsområde inte granskats systematiskt. Trots den höga metodologiska variationen i studierna som ingår i den aktuella granskningen är syftet med denna granskning att genomföra en systematisk granskning och bedöma robustheten i vetenskapliga bevis som stöder de positiva effekterna av oralt GABA (naturligt eller biosyntetiskt) intag på stress, sömn och relaterade psykofysiologiska åtgärder.
Metoder
Urval av studier
Inklusionskriterier
Inklusionskriterierna var följande:
• Resultatmått: stress, ångest, sömn och / eller relaterade psykofysiologiska parametrar
• Design: randomiserade kontrollerade studier och kvasi-experimentella studier
• Deltagare: Alla åldrar eller kön, friska eller ohälsosamma deltagare.
Exklusions kriterier
Uteslutningskriterierna var följande:
• Produkt: Syntetisk GABA (dvs. farmaceutiska ämnen)
• Design: Fallrapport, brev till redaktör, konferensbidrag, avhandling, personlig åsikt eller kommentar
• Djurstudier, in vitro- och ex vivo- studier.
Datakällor och sökstrategi
Vi genomförde en elektronisk litteratursökning på PubMed för att identifiera relevanta studier. Sökningen genomfördes fram till början av februari 2020. Söksträngarna som användes vid sökning var GABA OCH (stress ELLER sömn) INTE (gabapentin ELLER pregabalin). Artiklar valdes enligt föredragna rapporteringsartiklar för systematiska granskningar och metaanalyser (PRISMA) -diagrammet ( Moher et al., 2015 ; Shamseer et al., 2015 ). En granskare (PH) valde självständigt papper enligt ovannämnda kriterier för inkludering och uteslutning. Följande information extraherades från alla publikationer:
• Publikationsinformation : författare, år, tidskrift
• Deltagaregenskaper : antal rekryterade deltagare, antal deltagare som ingår i studien, antal deltagare (intervention), antal deltagare (kontroll), antal deltagare (annan intervention), hälsostatus, kön och åldersintervall
• Studiedesign : design och förblindning
• Interventionsegenskaper : interventionstid, tvättperiod, GABA-format, GABA-typ (naturlig eller biosyntetisk), GABA-dos, andra interventionstyper och doser
• Kontrollegenskaper : närvaro / frånvaro av kontroll / placebo, kontroll / placebodoser
• Resultatmått : frågeformulär för stress och sömn, kortisol, kromogranin A (CgA), immunglobulin A (IgA), adrenokortikotropiskt hormon (ACTH), adiponektin, hjärtfrekvens och hjärtfrekvensvariation, blodtryck, EEG-variabler
• Anmärkningar : anteckningar om de faktorer som kan påverka resultat / datakvalitet.
Studiekvaliteten bedömdes också med hjälp av Cochrane Collaborations verktyg för att bedöma risken för partiskhet i randomiserade studier ( Higgins et al., 2011 ).
Resultat
Vi identifierade 5 912 publikationer och screenade dem för att vara berättigade med hjälp av inkludering och uteslutningskriterier. Inledningsvis exkluderades 3 989 djurstudier, därefter ytterligare 10 in vitro- studier på människor. Ett tusen trehundra fyrtiosex studier som inte mätte stress och sömnrelaterade resultat exkluderades. Slutligen uteslöts 554 studier som inte undersökte konsumtionen av naturlig eller biosyntetisk GABA. Fjorton studier uppfyllde alla inklusionskriterier inkluderades i denna översyn ( figur 1 ).
En granskare (PH) utvärderade kvaliteten på de studier som ingår i denna granskning med hjälp av Cochrane Collaborations verktyg för att bedöma risken för partiskhet i randomiserade studier ( Higgins et al., 2011 ; Figur 2)). Majoriteten av studierna kategoriserades som med en oklar risk för selektionsbias, eftersom endast en av dem rapporterade metoden som användes för slumpmässig sekvensgenerering och allokeringsdöljning. Prestationsförskjutning, detektionsbias och förslitning observerades ha låg risk eftersom de flesta studierna var dubbelblinda och rapporterade alla resultaten. Risken för att rapportera bias var oklar eftersom vi inte var säkra på om forskare analyserade och rapporterade alla resultat som kunde extraheras från deras valda metoder. Slutligen fanns det en oklar fördom för potentiell intressekonflikt eftersom en eller flera författare till elva studier var anställda av ett industriföretag vid tidpunkten för publiceringen.
Sammanfattningar av alla studier presenteras i Tabell 1 (Metoder) och Tabell 2 (Resultat).
Effekten av GABA-konsumtion på stress
Två experimentella studier undersökte effekten av att konsumera GABA-berikade naturprodukter (som te och ris) på stress. Även om majoriteten av deltagargrupperna rapporterades vara friska varierade dosen GABA, interventionens varaktighet och de åtgärder som användes för att bedöma stress avsevärt.
En nyligen genomförd studie av Hinton et al. (2019) som undersökte de akuta effekterna av GABA Oolong-konsumtion på stress visade att både GABA Oolong-te (2,01 mg GABA / 200 ml te) och standard Oolong te (0,25 mg GABA / 200 ml te ) undersöktes ) ökat genomsnittligt RR-intervall (tiden mellan två på varandra följande R-vågor i elektrokardiogrammet). GABA Oolong hade emellertid ett större inflytande på hjärtfrekvensvariabilitet (HRV), vilket framkallade en större förändring i RR-intervallet hos höga jämfört med lågt stressade individer. Effekterna av GABA på andra HRV-parametrar och subjektiv stress var inte signifikanta. En annan studie av Yoshida et al. (2015)visade att 8 veckors konsumtion av GABA-ris (16,8 mg GABA i 150 g GABA-ris / dag) förbättrade den subjektiva lugn och oro i mitten av studien vid den fjärde behandlingsveckan jämfört med vitt ris (4,1 mg GABA i 150 g GABA-ris / dag) bibehölls dock inte dessa effekter. De rapporterade också trender för minskad blodkortisol och ökade adiponektinnivåer i tillståndet GABA-ris (mot vitt ris) vid den 8: e veckan av behandlingen. De observerade emellertid inga effekter på adrenokortikotropiskt hormon (ACTH) under något stadium av interventionen.
Alla de åtta experimentella studierna undersökte effekterna av (i) singel ( Abdou et al., 2006 ; Fujibayashi et al., 2008 ; Nakamura et al., 2009 ; Okita et al., 2009 ; Kanehira et al., 2011 ; Yoto et al., 2012 ; Yamastsu et al., 2015 ) och (ii) upprepade ( Yamatsu et al., 2013 ) biosyntetisk GABA-konsumtion på stress - främst på psykofysiologiska parametrar, med doser mellan 20-100 mg och deltagarnas antal mellan 7–63.
Fujibayashi et al. (2008) visade att 30 mg GABA-intag ökade (i) total effekt (TP) 30 och 60 minuter efter intag jämfört med baslinjen och (ii) högfrekvent effekt (HF) 30 min efter intag jämfört med baslinjen, men de misslyckades med att visa mellan gruppskillnader och skillnader i andra HRV-parametrar. Däremot Okita et al. (2009) rapporterade att placebotabletten ökade LF / HF-förhållandet och hjärtfrekvensen (HR) 20 och 40 minuter efter konsumtion. Denna ökning observerades inte i GABA-tillståndet (31,8 mg GABA), men de fann effekterna av GABA-konsumtion på andra parametrar inklusive strokevolym, hjärtutgång, HF- och LF-effekt, systoliskt blodtryck (SBP), diastoliskt blodtryck (DBP ) och genomsnittligt blodtryck (MBP). Använd elektroencefalografi (EEG), experiment 1 frånAbdou et al. (2006) visade att 100 mg GABA i 200 ml vatten ökade förändringar i (i) alfa-vågor (jämfört med vattentillstånd) och (ii) alfa / beta-förhållande (jämfört med vatten och teanintillstånd). De rapporterade också en trend för minskade förändringar för betavågor i GABA jämfört med vattenförhållanden. Den enda 4 veckors långa interventionsstudien med biosyntetisk GABA observerade en ökning av kortisolnivåerna i placebogruppen efter 2 och 4 veckors GABA-användning, men GABA-gruppen visade inte en sådan ökning ( Yamatsu et al., 2013 ).
De andra studierna använde olika metoder för att inducera stress hos deltagarna. Yamastsu et al. (2015) använde Uchida-Kraepelin Psychodiagnostic Test (UKT; Kuraishi, 2000 ), en aritmetisk uppgift för att inducera stress, och visade att 20 mg GABA i kaffe (jämfört med endast kaffe och vattenförhållanden) minskade kromogranin A (CgA) nivåer 30 min efter konsumtion. En liknande studie med användning av UKT- och CgA-nivåer ( Kanehira et al., 2011 ) visade att konsumtion av både 25 och 50 mg GABA i en 250 ml hypoton dryck (jämfört med endast hypotonisk dryck) sänkte salivcgA och kortisol hos individer med kronisk trötthet . Den subjektiva spänningen / ångestpoängen var dock inte signifikant. Nakamura et al. (2009)mätt både CgA och HRV och fann att 28 mg GABA i 10 g choklad, jämfört med 20 g choklad ensamt, minskade LF / HF-effekten 6,5-9,5 min efter den aritmetiska uppgiften (dvs = 36,5-39,5 min efter intag) HF-effekten 12–15 minuter efter den aritmetiska uppgiften (dvs. = 42–45 min efter intag). De rapporterade också att CgA-värdena ökade i chokladets enda tillstånd 30 och 50 minuter (jämfört med baslinjen) efter intag, en effekt som inte observerades i GABA-chokladtillstånd. Den elektrofysiologiska studien av Yoto et al. (2012)använde EEG för att visa att UKT minskade alfa- och beta-bandeffekten, medan 30 minuter efter ett 100 mg GABA-kapsel (vs. placebokapsel) intag hade denna minskning minskat. Även om deltagarna inte rapporterade en subjektiv ökning av avslappning och minskning av spännings / ångest och upphetsningspoäng. Till skillnad från studierna ovan, experiment 2 från Abdou et al. (2006) använde däremot en verklig stressuppgift där akrofoba deltagare ombads att korsa en upphängd bro. De upptäckte att kontrollgrupperna immunglobulin A (IgA) nivåer minskade i mitten och slutet av bron, men 100 mg GABA kapselgrupper IgA-nivåer visade inte detta mönster.
Effekten av GABA-konsumtion på sömn
Två åtta veckors interventionsstudier undersökte effekten av att konsumera GABA-berikat ris på sömnen hos friska individer. Yoshida et al. (2015) , som studerade friska medelålders individer med dålig sömn, fann en trend för förbättrade känslor vid uppvaknande i GABA-ris (16,8 mg GABA i 150 g GABA-ris / dag) (vs. vitt ris − 4,1 mg GABA i 150 g vitt ris / dag) grupp vid den fjärde interventionsveckan och efter två veckors intervention (dvs. vid den 10: e veckan). De fann ingen effekt av GABA-ris på VAS-sömnighetspoäng. Omvänt Okada et al. (2000)rapporterade hos postmenopausala kvinnor att konsumtionen av 26,4 mg GABA-ris 3 gånger om dagen (jämfört med kontrollris) förbättrade sömnlöshetspoängen för Kupperman klimakteriet vid den fjärde veckan av behandlingen. Dessutom undersökte endast en fyra veckors lång studie effekten av biosyntetisk GABA-konsumtion på sömn hos friska äldre deltagare. Med hjälp av OSA-sömninventariet visade de förbättringar i början och underhållet av sömn, sömnighet på morgonen och återhämtning från trötthetsvärden i GABA-gruppen efter 4 veckors behandling, även om de inte fann skillnader mellan GABA och placebogrupper ( Yamatsu et. al., 2013 ).
Tre interventionsstudier på 1 till 3 veckor (om än med mycket låga provstorlekar) undersökte effekterna av biosyntetisk GABA-konsumtion på sömn hos individer med dålig sömnkvalitet (en med PSQI> 5 målskyttar och två med PSQI> 6 målskyttar; PSQI : Pittsburgh Sleep Quality Index). I sin första 1 veckors långa interventionsstudie, Yamatsu et al. (2016)visade att intaget av 100 mg GABA-kapsel (kontra kontroll) förbättrade känslor vid uppvaknande, objektivt uppmätt minskad sömntid och ökad total sömntid för icke-REM (N1, N2 och N3 / SWS) efter ingrepp. De observerade också trender för förbättrad PSQI, sömntillfredsställelse och lättare att somna poäng och ökad ljus Icke-REM sömntid och sömneffektivitet i GABA (kontra kontroll) tillstånd efter behandling. De hittade emellertid inte signifikanta effekter för djup icke-REM (N3 / SWS) sömntid och tid (dvs varaktighet), REM-sömntid, uppvaknande frekvens eller delta vågkraft. I deras andra interventionsstudie på 1 vecka, Yamatsu et al. (2015), som studerade medelålders sovande som rapporterade att de hade dålig sömn, observerade en trend för minskad sömnfördröjning endast i 100 mg GABA kapsel (kontra kontroll) tillstånd. Resultat från PSQI-total, sömntillfredsställelse, känsla av att vakna, lätthet att somna poäng och icke-REM-sömntidsfördröjning, REM-sömntid, icke-REM-sömntid, uppvaknande frekvens och delta-vågkraft var inte signifikanta för GABA endast jämfört med annan intervention (AVLE och AVLE + GABA) och kontrollgrupper. Den senaste 4 veckor långa interventionsstudien på detta område av Byun et al. (2018), som studerade medelålders sovande som rapporterade att de hade dålig sömn rapporterade att intaget av 300 mg GABA-tablett (kontra kontrolltablett) minskade sömnstiden efter interventionen. De fann också att N2-sömn (%) och sömnlöshetsindex (ISI) minskade, liksom PSQI-total, PSQI-sömnkvalitet, PSQI-sömnlatens och PSQI-total sömntidspoäng i GABA-gruppen (före vs. efterbehandling) emellertid misslyckades de med att hitta skillnader mellan GABA och placebo / grupp. Dessutom fanns inga statistiskt signifikanta effekter av PSQI-sömneffektivitetspoäng och total sömntid, steg 1 och 3 Icke-REM-sömn (%), REM (%), vakna efter sömnstart (WASO; min), REM- sömnfördröjning, sömneffektivitet, upphetsningsindex, apné-hypopneaindex (AHI) och andningsbesvär (RDI).
Diskussion
Sammanfattning av de viktigaste resultaten
Denna systematiska granskning syftade till att fastställa den nuvarande statusen för kunskap om effekterna av naturlig och biosyntetisk GABA-konsumtion på stress och sömn. Sammantaget visade vår genomgång av litteraturen att det fanns låga till måttliga bevis för GABAs stress (på grund av att det finns fler studier med positiva resultat) och låga bevis för GABAs sömnfördelar.
Metoderna för studierna som ingår i denna översikt varierade signifikant men inkluderade både subjektiva och objektiva mått på stress och sömn. Majoriteten av studierna fann inte signifikanta subjektiva förbättringar av stresspoäng efter att ha konsumerat en enda dos av antingen naturliga eller biosyntetiska former av GABA. Bevis för utökad GABA-användning är blandad, Yoshida et al. (2015) studie som rapporterade förbättrad lugn och oro i GABA (vs. kontroll) -gruppen vid den fjärde behandlingsveckan, men inte med GABA-användning utöver det. Å andra sidan förbättrades bara några av de subjektiva sömnvärdena inklusive sömnstörningar, känslor vid uppvaknande, insättande och underhåll av sömn, sömnighet på morgonen och återhämtning från trötthetsresultat när det var en långvarig användning av GABA i minst en vecka (Okada et al., 2000 ; Yamatsu et al., 2013 , 2016 ). Återstående studier visade antingen trender mot förbättringar eller obetydlig subjektiv förbättring av sömnen. Det kan mycket väl vara så att långvarig naturlig användning av GABA krävs för att framkalla subjektiv stress och sömnfördelar.
Påfrestning
På grund av GABA: s BBB-permeabilitetsproblem använde de flesta studierna autonoma nervsystemet (ANS) -relaterade åtgärder (såsom HRV, kortisol och CgA) för att undersöka effekterna av GABA-konsumtion på stress. Abdou et al. (2006) och Yoto et al. (2012) använde EEG för att utvärdera den centrala effekten av GABA. Studierna med ANS-relaterade åtgärder visade positiva men ganska motstridiga resultat. Hinton et al. (2019) rapporterade ökade RR-intervall i GABA-tillståndet som återspeglar mer stabil ANS-funktion genom en ökning av vagal aktivitet (indikerar minskat stressrespons) ( Camm et al., 1996 ). På samma sätt, även om inga behandlingsskillnader rapporterades mellan GABA och kontrollförhållanden, Fujibayashi et al. (2008)visade en ökad TP i GABA-tillstånd 30 och 60 minuter efter intag (jämfört med baslinjen) vilket indikerar ANS-funktionalitet och anpassningsförmåga och minskad stress ( Camm et al., 1996 ). Samma studie rapporterade ökad HF i GABA-tillstånd 30 minuter efter intag (jämfört med baslinjen) vilket indikerar ökad PNS-aktivitet och minskad stress ( Berntson et al., 1997 ). Ökade RR-intervall, TP och HF antyder att GABA utövar sina effekter genom parasympatisk förstärkning utan eller mindre sympatiska effekter.
Resten av studierna som använde ANS-mått visade det motsatta aktiveringsmönstret. LF / HF, en markör för SNS-aktivitet och sympatovagal balans som ökar under stressförhållanden ( Pagani et al., 1991 ) ökade antingen inte ( Okita et al., 2009 ) eller reducerades i GABA-tillståndet ( Nakamura et al., 2009 ). På liknande sätt CgA, ett protein som frigörs tillsammans med noradrenalin i SNS ( Dimsdale et al., 1992 ) och kortisol, ett glukokortikoidhormon som frigörs av binjurebarken via (i) frisättning av adrenokortikotrop hormon genom reglering av hypotalamus-hypofysen - binjurexeln och (ii) SNS-innerveringen ( Engeland och Arnhold, 2005 ) reducerades i GABA kontra kontrollförhållanden (Nakamura et al., 2009 ; Kanehira et al., 2011 ; Yamastsu et al., 2015 ), vilket indikerar minskade stressnivåer. Dessutom befanns IgA, ett glykoprotein som regleras av SNS ( Carpenter et al., 1998 ) som är lägre i ångest ( Graham et al., 1988 ), minskat i kontroll men inte under GABA-förhållanden under en stressig uppgift. ( Abdou et al., 2006 ), vilket tyder på en stressskyddande effekt av GABA. Enligt dessa studier inducerade GABA avkoppling genom att modulera det sympatiska nervsystemet.
Även om det inte finns någon enighet om vilken uppdelning av det autonoma nervsystemet som påverkas mest av GABA-intaget, finns det begränsade bevis för att GABA också korsar BBB och utövar biologiska effekter på CNS. Stressreduktion och avkoppling är förknippade med förbättrade alfasvängningar ( Nobre et al., 2008 ), minskad betaaktivitet ( Ray och Cole, 1985 ) och ökat alfa / beta-förhållande ( Liang et al., 2019 ; Yi Wen och Mohd Aris, 2020 ). I linje med detta har Abdou et al. (2006) observerade ökade förändringar för alfa-vågor och alfa / beta-förhållande i GABA (vs. placebo) tillstånd, vilket tyder på förbättrad avkoppling. På samma sätt har Yoto et al. (2012)rapporterade att både alfa- och beta-vågor minskade på grund av en stressuppgift, men 30 minuter efter GABA-intag minskade denna minskning i GABA (kontra kontroll) tillstånd, vilket indikerar en stressskyddande effekt av GABA. Dessa resultat antyder att GABA passerar BBB antingen i små eller fulla mängder för att utöva biologiska effekter på CNS.
Sammanfattningsvis verkar stressmarkörer för båda divisionerna av ANS och CNS påverkas av oralt GABA-intag. Det är dock viktigt att notera att de effektiva doserna för stressreducerande och / eller stressskyddande fördelar varierar från 2,01 till 100 mg, där de lägre doserna upp till 30 mg verkar påverka de autonoma markörerna för stress och en dos på 100 mg. verkar påverka de centrala markörerna för stress. Dessutom verkar effektiva doser för naturlig GABA vara lägre än för biosyntetiska former. Även om naturligt GABA-intag och stressforskning är mycket begränsat kan dessa resultat också hänföras till de andra bioaktiva föreningarna som finns naturligt i livsmedel som har stressreducerande fördelar såsom l-theanin ( Juneja et al., 1999 ) och epigallocatechin gallate (EGCG) i te ( Scholey et al., 2012). Ytterligare studier är motiverade för att undersöka (i) naturlig och biosyntetisk GABA-biotillgänglighet hos människor efter oralt intag för att förstå GABAs verkningsmekanism för varje typ av GABA, (ii) minimala och optimala naturliga och biosyntetiska GABA-doser som krävs för stressfördelar, och (iii) minimala och optimala naturliga och biosyntetiska GABA-doser som krävs för att påverka stressreduktion / avslappning perifert och centralt.
Sömn
Det finns bara mycket begränsade stödjande bevis för rollen av oralt GABA-intag för objektiv sömnförbättring. Byun et al. (2018) , vars deltagare fick dos 1 timme innan de sov, rapporterade att användning av GABA under fyra veckor minskade sömnfördröjningen i GABA-gruppen (vs. kontroll). På liknande sätt har Yamatsu et al. (2016) , med dosering 30 minuter före sömn, visade att en veckas GABA-intervention minskade sömnstiden och ökade den totala sömntiden för icke-REM i GABA (kontra kontroll) tillstånd. I en tidigare studie med samma doseringsregim, Yamatsu et al. (2015)observerade endast en trend mot minskad sömnfördröjning efter 1 veckas GABA-konsumtion. Alla tre studierna misslyckades med att visa fördelaktiga effekter av GABA-intag på andra sömnmarkörer, såsom sömneffektivitet, REM-sömntid, uppvakningsfrekvens etc. Dessa resultat tyder på att långvarigt GABA-intag (dvs. upprepad dosering över dagar) kan vara fördelaktigt för naturligt inducerande sömn snarare än att upprätthålla sömn, eftersom bevis visade att GABA främst påverkar sömnstart och tidiga sömnstadier som inträffar tidigt på natten (dvs. nattens första icke-REM), men inte de sömnstadier som inträffar senare på natten. Detta kan förklaras av den farmakokinetiska profilen för GABA, som kännetecknas av en snabb ökning (30 minuter efter oral administrering) och sedan minskning (60 minuter efter oral administrering) i plasmakoncentrationer. Med andra ord, den snabba höjningen i blodet kan GABA-nivåerna förklara varför det påverkar differentiellt tidiga sömnmarkörer. Dessutom finns det ett dubbelriktat samband mellan sömn och både akut och kronisk ångest där sömnstörningar observeras hos individer med ångest (Soehner och Harvey, 2012 ) och sömnstörningar kan förutsäga utvecklingen av en ångestsyndrom ( Neckelmann et al., 2007 ). Specifikt har ökad latens för sömn observerats vid ångest och relaterade störningar ( Cox och Olatunji, 2016 ) och stress ( Maskevich et al., 2020 ). Därför kan fördelarna med tidigt sömnstadium med GABA-konsumtion förknippas med GABAs stressreducerande egenskaper snarare än direkt sömnframkallande och / eller upprätthållande av fördelar i sig.. Bristen på sömnunderhållsrelaterade fördelar med GABA kan också förklaras av (i) små och ojämna gruppstorlekar som maskerar verkliga förbättringar, (ii) otillräckliga GABA-mängder som inte driver SWS- och REM-svar och (iii) som inte använder split -natt PSG / EEG och maskering av de betydande förändringar som bara kan vara uppenbara i olika delar av natten.
Upprepat GABA-intag över dagar kan förbättra parametrarna för tidig sömn; Det är dock viktigt att notera att doser som krävs för att framkalla sömnfördelar (mellan 100 och 300 mg för biosyntetisk GABA) verkar vara högre än för stressfördelar (varierar mellan 20 och 100 mg för biosyntetisk och 2,01 och 26,4 mg för naturliga GABA) och verkar kräva en långvarig användning (1–8 veckor) för att bara förbättra tidiga sömnåtgärder. Med detta sagt verkar doser som sträcker sig mellan 100 och 300 mg vara effektiva för att minska sömnstiden med långvarig användning av 1–4 veckor. Återigen är det viktigt att notera att alla sömnstudier som rapporterade förbättrade objektiva sömnmått använde biosyntetiska former av GABA. Framtida forskning krävs för att förstå (i) de minimala och optimala naturliga och biosyntetiska GABA-doserna som krävs för att påverka olika sömnsteg,
Begränsningar
Den pågående översynen var föremål för flera begränsningar. För det första var kvaliteten på många av de granskade studierna tveksam på grund av potentiella intressekonflikter, lågt deltagande antal och ojämna kontroll- och interventionsgrupper. För det andra har inte alla studier bedömt samma stress- och / eller sömnparametrar eller använt samma design, varför ingen kvantitativ metaanalys kunde utföras på grund av heterogeniteten hos de extraherade data. För det tredje, även om PICOS (patientintervention-kontroll-utfall-studiedesign) användes för att extrahera data, fanns det bara en datautdragare och inget validerat verktyg har använts. Slutligen, på grund av det begränsade antalet heterogena studier inom detta område, kunde den exakta dosen för effektivitet för både stress- och sömnfördelar inte fastställas varken i den aktuella översynen eller i den allmänna vetenskapliga litteraturen. Därmed,
Slutsats
Denna översikt erbjuder en omfattande bedömning av den aktuella GABA-litteraturen och visar att naturligt och biosyntetiskt GABA-intag kan ha fördelaktiga effekter på stress och sömn. På grund av små provstorlekar och heterogenitet hos de använda metoderna är det dock nödvändigt med ytterligare forskning för att fastställa dostid, varaktighet och svarsförhållanden för både naturliga och biosyntetiska former av GABA för att på ett tillförlitligt sätt framkalla akut eller kronisk stress och sömneffekter.
Uttalande om datatillgänglighet
Alla datamängder som presenteras i denna studie ingår i artikeln.
Författarens bidrag
PH skrev manuskriptet med inmatning från JG, JN och AS som också bidragit till revisionen av manuskriptet kritiskt för viktigt intellektuellt innehåll. Alla författare bidrog till artikeln och godkände den inlämnade versionen.
Finansiering
Erhållna medel från Unilever UK Central Resources Limited för att täcka publiceringsavgifter för öppen tillgång.
Intressekonflikt
PH är anställd av Unilever UK Central Resources Limited. JG, JN och AS har fått forskningsfinansiering, konsulttjänster, resestöd och talaravgifter från olika industriföretag.
Referenser
Abdou, AM, Higashiguchi, S., Horie, K., Kim, M., Hatta, H. och Yokogoshi, H. (2006). Avslappnings- och immunförstärkningseffekter av gamma-aminosmörsyra (GABA) -administrering hos människor. Biofaktorer 26, 201–208. doi: 10.1002 / biof.5520260305
Al-Sarraf, H. (2002). Transport av 14C-gamma-aminosmörsyra till hjärnan, cerebrospinalvätska och koroid plexus hos nyfödda och vuxna råttor. Dev. Brain Res. 139, 121–129. doi: 10.1016 / S0165-3806 (02) 00537-0
Bassett, ML, Mullen, KD, Scholz, B., Fenstermacher, JD och Jones, EA (1990). Ökat hjärnupptag av γ-aminosmörsyra i en kaninmodell av leverencefalopati. Gastroenterologi 98, 747-757. doi: 10.1016 / 0016-5085 (90) 90298-F
Berntson, GG, Bigger, JT Jr, Eckberg, DL, Grossman, P., Kaufmann, PG, Malik, M., et al. (1997). Hjärtfrekvensvariation: ursprung, metoder och tolkningsförbehåll. Psykofysiologi 34, 623–648. doi: 10.1111 / j.1469-8986.1997.tb02140.x
Boonstra, E., de Kleijn, R., Colzato, LS, Alkemade, A., Forstmann, BU och Nieuwenhuis, S. (2015). Neurotransmittorer som kosttillskott: effekterna av GABA på hjärnan och beteendet. Främre. Psykol. 6: 1520. doi: 10.3389 / fpsyg.2015.01520
Bouche, N., Lacombe, B. och Fromm, H. (2003). GABA-signalering: en bevarad och allestädes närvarande mekanism. Trender Cell. Biol. 13, 607–610. doi: 10.1016 / j.tcb.2003.10.001
Byun, JI, Shin, YY, Chung, SE och Shin, WC (2018). Säkerhet och effekt av gamma-aminosmörsyra från fermenterad risgrodd hos patienter med sömnlöshetssymptom: en randomiserad, dubbelblind studie. J. Clin. Neurol. 14, 291–295. doi: 10.3988 / jcn.2018.14.3.291
Camm, AJ, Malik, M., Bigger, JT, Breithardt, G., Cerutti, S., Cohen, RJ, et al. (1996). Pulsvariation: mätstandarder, fysiologisk tolkning och klinisk användning. Cirkulation 93, 1043–1065. doi: 10.1161 / 01.CIR.93.5.1043
Carpenter, GH, Garrett, JR, Hartley, RH och Proctor, GB (1998). Påverkan av nerver på utsöndringen av immunglobulin A i submandibulär saliv hos råttor. J. Physiol . 512, 567–573. doi: 10.1111 / j.1469-7793.1998.567be.x
Cox, RC och Olatunji, BO (2016). En systematisk genomgång av sömnstörningar vid ångest och relaterade störningar. J. Angst Disord. 37, 104–129. doi: 10.1016 / j.janxdis.2015.12.001
Cryan, JF och Dinan, TG (2012). Sinnesförändrande mikroorganismer: inverkan av tarmmikrobioten på hjärnan och beteendet. Nat. Pastor Neurosci. 13, 701–712. doi: 10.1038 / nrn3346
DeWoskin, D., Myung, J., Belle, MD, Piggins, HD, Takumi, T. och Forger, DB (2015). Distinkta roller för GABA över flera tidsskalor vid dygnsdagsvis tidtagning. Proc. Natl. Acad. Sci. USA 112, E3911–3919. doi: 10.1073 / pnas.1420753112
Dhakal, R., Bajpai, VK och Baek, K.-H. (2012). Produktion av gaba (γ - aminosmörsyra) av mikroorganismer: en översyn. Braz. J. Microbiol. 43, 1230–1241. doi: 10.1590 / S1517-83822012000400001
Diana, M., Quílez, J. och Rafecas, M. (2014). Gamma-aminosmörsyra som en bioaktiv förening i livsmedel: en översyn. J. Funct. Livsmedel 10, 407–420. doi: 10.1016 / j.jff.2014.07.004
Dimsdale, JE, O'Connor, DT, Ziegler, M. och Mills, P. (1992). Kromogranin A korrelerar med noradrenalinfrisättningshastighet. Life Sci. 51, 519–525. doi: 10.1016 / 0024-3205 (92) 90029-O
Engeland, WC och Arnhold, MM (2005). Neurala kretsar vid reglering av binyrebarkens kortikosteronrytm. Endokrin 28, 325–332. doi: 10.1385 / ENDO: 28: 3: 325
Erdö, SL (1985). Perifera GABAergiska mekanismer. Trender Pharmacol. Sci. 6, 205–208. doi: 10.1016 / 0165-6147 (85) 90096-3
Fujibayashi, M., Kamiya, T., Takagaki, K. och Moritani, T. (2008). Aktivering av autonoma nervsystemets aktivitet genom oral intag av GABA. Nippon Eiyo Shokuryo Gakkaishi 61, 129–133. doi: 10.4327 / jsnfs.61.129
Gottesmann, C. (2002). GABA-mekanismer och sömn. Neurovetenskap 111, 231–239. doi: 10.1016 / S0306-4522 (02) 00034-9
Graham, NM, Bartholomeusz, RC, Taboonpong, N. och La Brooy, JT (1988). Minskar ångest utsöndringsgraden av sekretorisk IgA i saliv? Med. J. Austr. 148, 131–133. doi: 10.5694 / j.1326-5377.1988.tb112773.x
Higgins, JPT, Altman, DG, Gøtzsche, PC, Jüni, P., Moher, D., Oxman, AD, et al. (2011). Cochran-samarbetets verktyg för att bedöma risken för partiskhet i randomiserade studier. Br. Med. J. 343: d5928. doi: 10.1136 / bmj.d5928
Hinton, T., Jelinek, HF, Viengkhou, V., Johnston, GA och Matthews, S. (2019). Effekt av GABA-berikat oolongte på att minska stress i en universitetskohort. Främre. Nutr. 6:27. doi: 10.3389 / fnut.2019.00027
Jie, F., Yin, G., Yang, W., Yang, M., Gao, S., Lv, J., et al. (2018). Stress vid reglering av GABA-amygdala-systemet och relevans för neuropsykiatriska sjukdomar. Främre. Neurosci. 12: 562. doi: 10.3389 / fnins.2018.00562
Juneja, LR, Chu, D.-C., Okubo, T., Nagato, Y. och Yokogoshi, H. (1999). L-teanin - en unik aminosyra av grönt te och dess avslappningseffekt hos människor. Trender Mat Sci. Technol. 10, 199–204. doi: 10.1016 / S0924-2244 (99) 00044-8
Kanehira, T., Nakamura, Y., Nakamura, K., Horie, K., Horie, N., Furugori, K., et al. (2011). Att lindra yrkesmässig utmattning genom konsumtion av en dryck som innehåller gamma-aminosmörsyra. J. Nutr. Sci. Vitaminol. 57, 9–15. doi: 10.3177 / jnsv.57.9
Knudsen, GM, Poulsen, HE, och Paulson, OB (1988). Blod-hjärnbarriärpermeabilitet vid galaktosamininducerad leverencefalopati: inga bevis för ökad GABA-transport. J. Hepatol. 6, 187–192. doi: 10.1016 / S0168-8278 (88) 80030-8
Kuraishi, S. (2000). Utveckling av det "uchida-kraepelin psykodiagnostiska testet" i Japan. Psychologia 1, 104–109.
Kuriyama, K. och Sze, PY (1971). Blod-hjärnbarriär mot H3-y-aminosmörsyra i normala djur och aminooxiättiksyra-behandlade djur. Neurofarmakologi 10, 103–108. doi: 10.1016 / 0028-3908 (71) 90013-X
Li, H., Qiu, T., Huang, G. och Cao, Y. (2010). Produktion av gamma-aminosmörsyra med lactobacillus brevis NCL912 med användning av matad satsjäsning. Microb. Cellfakta. 9:85. doi: 10.1186 / 1475-2859-9-85
Liang, G., Xu, X., Zheng, Z., Xing, X. och Guo, J. (2019). EEG-signalindikator för emotionell reaktivitet, ” Paper presenterat vid den internationella konferensen om hjärninformatik (Haikou). doi: 10.1007 / 978-3-030-37078-7_1
Liao, W.-C., Wang, C.-Y., Shyu, Y.-T., Yu, R.-C. och Ho, K.-C. (2013). Inverkan av förbehandlingsmetoder och jäsning av adzukibönor på γ-aminosmörsyra (GABA) ackumulering av mjölksyrabakterier. J. Funct. Livsmedel 5, 1108–1115. doi: 10.1016 / j.jff.2013.03.006
Luppi, PH, Peyron, C. och Fort, P. (2017). Inte en enda men flera populationer av GABAergiska nervceller kontrollerar sömn. Sleep Med. Upp 32, 85–94. doi: 10.1016 / j.smrv.2016.03.002
Maskevich, S., Cassanet, A., Allen, NB, Trinder, J. och Bei, B. (2020). Sömn och stress hos ungdomar: rollen som upphetsning och hantering före sömnen under skolan och semestern. Sleep Med. 66, 130–138. doi: 10.1016 / j.sleep.2019.10.006
Moher, D., Shamseer, L., Clarke, M., Ghersi, D., Liberati, A., Petticrew, M., et al. (2015). Föredragna rapporteringspunkter för systematisk granskning och metaanalysprotokoll (PRISMA-P) 2015-uttalande. Syst. Upp 4: 1. doi: 10.1186 / 2046-4053-4-1
Nakamura, H., Takishima, T., Kometani, T. och Yokogoshi, H. (2009). Psykologisk stressreducerande effekt av choklad berikad med gamma-aminosmörsyra (GABA) hos människor: bedömning av stress med hjälp av hjärtfrekvensvariation och salivkromogranin A. Int. J. Food Sci. Nutr. 60, 106–113. doi: 10.1080 / 09637480802558508
Neckelmann, D., Mykletun, A. och Dahl, AA (2007). Kronisk sömnlöshet som en riskfaktor för att utveckla ångest och depression. Sov 30, 873–880. doi: 10.1093 / sleep / 30.7.873
Nemeroff, CB (2003). GABA: s roll i patofysiologin och behandlingen av ångeststörningar. Psykofarmakol. Tjur. 37, 133–146.
Nobre, AC, Rao, A. och Owen, GN (2008). L-teanin, en naturlig beståndsdel i te, och dess effekt på mentalt tillstånd. Asia Pacific J. Clin. Nutr. 17 (tillägg 1), 167–168.
Nuss, P. (2015). Ångeststörningar och GABA-neurotransmission: en störning av modulering. Neuropsykiatr. Dis. Behandla. 11, 165–175. doi: 10.2147 / NDT.S58841
Okada, T., Sugishita, T., Murakami, T., Murai, H., Saikusa, T., Horino, T., et al. (2000). Effekt av den avfettade risbakterien berikad med GABA för sömnlöshet, depression, autonom störning genom oral administrering. Nippon Shokuhin Kagaku Kogaku Kaishi 47, 596–603. doi: 10.3136 / nskkk.47.596
Okita, Y., Nakamura, H., Kouda, K., Takahashi, I., Takaoka, T., Kimura, M., et al. (2009). Effekter av grönsak som innehåller gamma-aminosmörsyra på hjärtets autonoma nervsystem hos friska unga människor. J Physiol. Antropol. 28, 101–107. doi: 10.2114 / jpa2.28.101
Olney, JW (1990). Excitotoxiska aminosyror och neuropsykiatriska störningar. Annu. Pastor Pharmacol. Toxicol. 30, 47–71. doi: 10.1146 / annurev.pa.30.040190.000403
Pagani, M., Mazzuero, G., Ferrari, A., Liberati, D., Cerutti, S., Vaitl, D., et al. (1991). Sympathovagal interaktion under mental stress. En studie med spektralanalys av hjärtfrekvensvariation hos friska kontrollpersoner och patienter med tidigare hjärtinfarkt. Cirkulation 83 (tillägg 4), 1143–1151.
Petroff, OA (2002). GABA och glutamat i människans hjärna. Neuroscientist 8, 562–573. doi: 10.1177 / 1073858402238515
Rashmi, D., Zanan, R., John, S., Khandagale, K. och Nadaf, A. (2018). Kapitel 13 - γ-aminosmörsyra (GABA): biosyntes, roll, kommersiell produktion och applikationer. Hingst. Nat. Produkter Chem. 57, 413–452. doi: 10.1016 / B978-0-444-64057-4.00013-2
Ray, W. och Cole, H. (1985). EEG alfa-aktivitet återspeglar uppmärksamhetskrav, och beta-aktivitet återspeglar emotionella och kognitiva processer. Vetenskap 228, 750–752. doi: 10.1126 / science.3992243
Riemann, D., Nissen, C., Palagini, L., Otte, A., Perlis, ML och Spiegelhalder, K. (2015). Neurobiologi, undersökning och behandling av kronisk sömnlöshet. Lancet Neurol. 14, 547–558. doi: 10.1016 / S1474-4422 (15) 00021-6
Roberts, E. (1974). γ-aminosmörsyra och nervsystemets funktion - Ett perspektiv. Biochem. Pharmacol. 23, 2637-2649. doi: 10.1016 / 0006-2952 (74) 90033-1
Roberts, E. och Eidelberg, E. (1960). Metaboliska och neurofysiologiska roller av gamma-aminosmörsyra. Int. Pastor Neurobiol. 2, 279–332. doi: 10.1016 / S0074-7742 (08) 60125-7
Roberts, E. och Frankel, S. (1950). gamma-aminosmörsyra i hjärnan: dess bildning av glutaminsyra. J. Biol. Chem. 187, 55–63.
Satya Narayan, V. och Nair, PM (1990). Metabolism, enzymologi och möjliga roller av 4-aminobutyrat i högre växter. Fytokemi 29, 367–375. doi: 10.1016 / 0031-9422 (90) 85081-P
Scholey, A., Downey, LA, Ciorciari, J., Pipingas, A., Nolidin, K., Finn, M., et al. (2012). Akuta neurokognitiva effekter av epigallocatechin gallate (EGCG). Aptit 58, 767–770. doi: 10.1016 / j.appet.2011.11.016
Schwartz, RD (1988). GABAa-receptorgaterade jonkanaler: biokemiska och farmakologiska studier av struktur och funktion. Biochem. Pharmacol. 37, 3369–3375. doi: 10.1016 / 0006-2952 (88) 90684-3
Shamseer, L., Moher, D., Clarke, M., Ghersi, D., Liberati, A., Petticrew, M., et al. (2015). Föredragna rapporteringsobjekt för systematisk granskning och metaanalysprotokoll (PRISMA-P) 2015: utarbetande och förklaring. Br. Med. J. 350: g7647. doi: 10.1136 / bmj.g7647
Shyamaladevi, N., Jayakumar, AR, Sujatha, R., Paul, V. och Subramanian, EH (2002). Bevis för att kväveoxidproduktion ökar gamma-aminosmörsyras permeabilitet i blod-hjärnbarriären. Brain Res. Tjur. 57, 231–236. doi: 10.1016 / S0361-9230 (01) 00755-9
Soehner, AM och Harvey, AG (2012). Förekomst och funktionella konsekvenser av allvarliga sömnlöshetssymptom vid humör och ångest: resultat från ett nationellt representativt urval. Sov 35, 1367–1375. doi: 10.5665 / sleep.2116
Steward, FC, Thompson, JF och Dent, CE (1949). γ-aminosmörsyra: en beståndsdel i potatisknölen? Vetenskap 110, 439–440.
Takanaga, H., Ohtsuki, S., Hosoya, K. och Terasaki, T. (2001). GAT2 / BGT-1 som ett system som ansvarar för transporten av gamma-aminosmörsyra vid musblod-hjärnbarriären. J. Cereb. Metab för blodflöde. 21, 1232–1239. doi: 10.1097 / 00004647-200110000-00012
Yamastsu, A., Yoneyama, M., Kim, M., Yamashita, Y., Horie, K., Yokogoshi, H., et al. (2015). De positiva effekterna av kaffe på stress och trötthet kan förbättras genom tillsats av GABA - En randomiserad, dubbelblind, placebokontrollerad, crossover-designad studie. Jpn. Pharmacol. Ther. 43, 515–519.
Yamatsu, A., Yamashita, Y., Horie, K., Takeshima, K., Horie, N., Masuda, K., et al. (2013). GABA: s gynnsamma verkan vid sömn och frekvent urinering på natten hos äldre. Jpn. Pharmacol. Ther. 41, 985–988.
Yamatsu, A., Yamashita, Y., Maru, I., Yang, J., Tatsuzaki, J. och Kim, M. (2015). Förbättring av sömn genom oralt intag av GABA och apocynum venetum leaf extract. J. Nutr. Sci. Vitaminol. 61, 182–187. doi: 10.3177 / jnsv.61.182
Yamatsu, A., Yamashita, Y., Pandharipande, T., Maru, I. och Kim, M. (2016). Effekt av oral gamma-aminosmörsyra (GABA) på sömn och dess absorption hos människor. Mat Sci. Bioteknik. 25, 547–551. doi: 10.1007 / s10068-016-0076-9
Yi Wen, T. och Mohd Aris, SA (2020). Elektroencefalogram (EEG) stressanalys på alfa / beta-förhållande och teta / beta-förhållande. Ind. J. Elect. Eng. Komp. Sci. 17: 175. doi: 10.11591 / ijeecs.v17.i1.pp175-182
Yoshida, S., Haramoto, M., Fukuda, T., Mizuno, H., Tanaka, A., Nishimura, M., et al. (2015). Optimering av en γ-aminosmörsyra (GABA) anrikningsprocess för vitt ris av hokkaido och effekterna av GABA-anrikat vitt ris på stressavlastning hos människor. Nippon Shokuhin Kagaku Kogaku Kaishi 62, 95–103. doi: 10.3136 / nskkk.62.95
Yoto, A., Murao, S., Motoki, M., Yokoyama, Y., Horie, N., Takeshima, K., et al. (2012). Oralt intag av γ-aminosmörsyra påverkar humör och aktiviteter i centrala nervsystemet under stressat tillstånd som orsakas av mentala uppgifter. Aminosyror 43, 1331–1337. doi: 10.1007 / s00726-011-1206-6
Nyckelord: gammaaminosmörsyra (GABA), stress, sömn, näringsämnen, kosttillskott
Citation: Hepsomali P, Groeger JA, Nishihira J och Scholey A (2020) Effekter av oral Gamma-aminosmörsyra (GABA) -administration på stress och sömn hos människor: En systematisk granskning. Främre. Neurosci. 14: 923. doi: 10.3389 / fnins.2020.00923
Mottagen: 7 maj 2020; Accepterat: 10 augusti 2020;
Publicerad: 17 september 2020.
Granskats av:
Daniela Calvetti , Case Western Reserve University, USAHercules Rezende Freitas , UC Davis MIND Institute, USA
Copyright © 2020 Hepsomali, Groeger, Nishihira och Scholey. Detta är en artikel med öppen tillgång som distribueras under villkoren i Creative Commons Attribution License (CC BY) . Användning, distribution eller reproduktion i andra forum är tillåten, förutsatt att den ursprungliga författaren (arna) och upphovsrättsinnehavaren (arna) krediteras och att den ursprungliga publikationen i denna tidskrift citeras, i enlighet med accepterad akademisk praxis. Ingen användning, distribution eller reproduktion är tillåten som inte uppfyller dessa villkor.
* Korrespondens: Piril Hepsomali, piril.hepsomali@unilever.com
Effekter av oral Gamma-aminosmörsyra (GABA) -administration på stress och sömn hos människor: En systematisk översikt
- Unilever R&D, Bedford, Storbritannien
- 2 Institutionen för psykologi, School of Social Sciences, Nottingham Trent University, Nottingham, Storbritannien
- 3 Institutionen för medicinsk förvaltning och informatik, Hokkaido Information University, Hokkaido, Japan
- 4 Center for Human Psychopharmacology, School of Health Sciences, Swinburne University, Hawthorn, VIC, Australien
Gamma-aminosmörsyra (GABA) är en icke-proteinogen aminosyra och är den huvudsakliga hämmande neurotransmittorn i däggdjurshjärnan. GABAs stressreducerande och sömnförstärkande effekter har fastställts. Men även om flera kliniska prövningar på människa har genomförts, blandas resultaten avseende naturligt och / eller biosyntetiskt oralt GABA-intag på stress och sömn. Vi genomförde en systematisk granskning för att undersöka om naturligt och / eller biosyntetiskt oralt GABA-intag påverkar stress och sömn. Vi sökte systematiskt på PubMed-databasen efter studier publicerade fram till februari 2020 enligt PRISMA-riktlinjer. Endast placebokontrollerade humana prövningar som bedömde stress, sömn och relaterade psykofysiologiska resultat som ett svar på naturlig GABA (dvs. GABA som finns naturligt i livsmedel) eller biosyntetisk GABA (dvs. GABA som produceras via jäsning) intag ingick. Fjorton studier uppfyllde kriterierna och ingick i den systematiska granskningen. Även om det behövs fler studier innan några slutsatser kan göras om effekten av oral GABA-konsumtion på stress och sömn, visar resultaten att det finns begränsat bevis för stress och mycket begränsat bevis för sömnfördelar med oralt GABA-intag.
Introduktion
Gamma-aminosmörsyra (GABA) är en icke-proteinogen aminosyra med fyra kol som finns i bakterier, växter och ryggradsdjur. Ursprungligen upptäcktes det i växter ( Steward et al., 1949 ), det identifierades sedan i däggdjurshjärnan ( Roberts och Frankel, 1950 ) och därefter hos djur ( Roberts och Eidelberg, 1960 ) och flera andra organismer - inklusive bakterier och svampar ( Bouche et al., 2003 ). Hos ryggradsdjur genereras den av den irreversibla a-dekarboxyleringsreaktionen av L-glutaminsyra eller dess salter, katalyserad av glutaminsyradekarboxylasenzym ( Satya Narayan och Nair, 1990 ) och fungerar som en hämmande neurotransmittor i centrala nervsystemet (CNS) (Roberts och Frankel, 1950 ; Petroff, 2002 ), Det har också hittats i flera perifera vävnader ( Erdö, 1985 ). GABA är avgörande för CNS-funktionen, där ~ 60–75% av alla synapser är GABAergiska ( Schwartz, 1988 ).
Förutom sin roll som neurotransmittor finns GABA också naturligt i olika livsmedel, såsom te, tomat, sojabönor, grodd ris och vissa fermenterade livsmedel, och kan erhållas från en normal diet ( Diana et al., 2014 ; Rashmi et al., 2018 ). Till exempel innehåller vitt te och adzukibönor 0,5 respektive 2,01 g / kg GABA ( Zhao et al., 2011 ; Liao et al., 2013 ). Å andra sidan kan mycket högre koncentrationer av GABA produceras genom mjölksyrabakterier (LAB) fermentering ( Dhakal et al., 2012 ). Genom att till exempel använda Lactobacillus brevis NCL912-stam, kunde 103,5 g / l GABA produceras ( Li et al., 2010). Nyligen har LAB GABA fått betydande uppmärksamhet och har i stor utsträckning använts som en funktionell livsmedelsingrediens på olika marknader på grund av dess potentiella hälsofördelar associerade med GABA ( Boonstra et al., 2015 ).
Det är värt att nämna att GABA länge har ansetts vara oförmöget att korsa blod-hjärnbarriären (BBB) ( Kuriyama och Sze, 1971 ; Roberts, 1974 ), vilket väcker frågor om verkningsmekanismerna bakom dess hälsofördelar. Det finns dock olika konton angående GABA: s BBB-permeabilitet. Medan vissa forskare hävdar att endast små mängder GABA korsar BBB ( Knudsen et al., 1988 ; Bassett et al., 1990 ), med upptäckten av GABA-transportsystem i hjärnan (dvs. överföring av lösta ämnen genom transcytos, bärare -medierad transport, eller enkel diffusion av hydrofoba ämnen), andra tror att de betydande mängderna av GABA skulle kunna korsa BBB ( Takanaga et al., 2001 ;Al-Sarraf, 2002 ; Shyamaladevi et al., 2002 ). Eftersom GABA också är närvarande i det enteriska nervsystemet har man ansett att GABA kan verka på det perifera nervsystemet genom tarm-hjärnaxeln ( Cryan och Dinan, 2012 ). Även om det finns vissa bevis som visar att biosyntetisk GABA kan nå den mänskliga hjärnan, vilket framgår av olika EEG-svar ( Abdou et al., 2006 ; Yoto et al., 2012 ), hittills finns det inga data som visar GABA: s BBB-permeabilitet hos människor. Även om det har visats att GABA-nivåerna i blodet höjdes 30 minuter efter oralt GABA-intag ( Yamatsu et al., 2016 ), är det inte känt om oralt GABA-intag skulle öka GABA-koncentrationer i hjärnan eller inte.
Med tanke på den allestädes närvarande rollen som GABA som en hämmande neurotransmittor, tillsammans med dess utbredda distribution, är det inte förvånande att det har varit inblandat i ett stort antal beteenden ( Olney, 1990 ). Dessa inkluderar ångest- och stressreglering, dygnsrytm och sömnreglering, minnesförbättring, humör och till och med upplevelse av smärta ( Diana et al., 2014 ; Rashmi et al., 2018 ). Låga nivåer av GABA eller nedsatt GABA-funktion är associerad med etiologi och upprätthållande av akut och kronisk stress ( Jie et al., 2018 ), ångeststörningar ( Nemeroff, 2003 ) och sömnstörningar som sömnlöshet ( Gottesmann, 2002). Specifikt reglerar GABAergiska nervceller och neurotransmittorer hjärnkretsarna i (i) amygdala för att modulera stress och ångestsvar både under normala och patologiska förhållanden ( Nuss, 2015 ), (ii) kortikomedulära vägar för att modulera både snabb ögonrörelse (REM ) och icke-REM, särskilt långsam sömn (SWS) ( Luppi et al., 2017 ) och (iii) de suprachiasmatiska kärnorna (SCN) för att modulera dygnsrytmen ( DeWoskin et al., 2015 ). Allosteriska platser på GABAa-receptorerna tillåter också att nivån av hämning av nervceller i relevanta hjärnregioner regleras med hög noggrannhet, och dessa platser är de molekylära målen för både ångestdämpande och hypnotiska läkemedel ( Nuss, 2015 ; Riemann et al., 2015). Därför använder den farmakologiska behandlingen av ångeststörningar och sömnlöshet vanligtvis en bensodiazepinreceptoragonist som påverkar GABAergic transmission ( Nemeroff, 2003 ; Riemann et al., 2015 ) som verkar genom att öka bindningen av GABA till GABAa-receptorer för att förbättra hämmande signaler till cellgrupper som reglerar upphetsning. Detta resulterar i minskad stress och ångest, minskad sömnlatens och ökad sömnkontinuitet ( Gottesmann, 2002 ; Nemeroff, 2003 ; Nuss, 2015 ).
Medan ett begränsat antal mänskliga prövningar med ett brett spektrum av metoder (när det gäller dosen GABA, interventionens varaktighet och åtgärder som används för att bedöma stress och sömn) har undersökt effekten av icke-farmakologiska metoder för att minska stress och förbättra olika aspekter av sömn genom att använda naturligt och biosyntetiskt GABA-intag, så vitt vi vet har detta forskningsområde inte granskats systematiskt. Trots den höga metodologiska variationen i studierna som ingår i den aktuella granskningen är syftet med denna granskning att genomföra en systematisk granskning och bedöma robustheten i vetenskapliga bevis som stöder de positiva effekterna av oralt GABA (naturligt eller biosyntetiskt) intag på stress, sömn och relaterade psykofysiologiska åtgärder.
Metoder
Urval av studier
Inklusionskriterier
Inklusionskriterierna var följande:
• Resultatmått: stress, ångest, sömn och / eller relaterade psykofysiologiska parametrar
• Design: randomiserade kontrollerade studier och kvasi-experimentella studier
• Deltagare: Alla åldrar eller kön, friska eller ohälsosamma deltagare.
Exklusions kriterier
Uteslutningskriterierna var följande:
• Produkt: Syntetisk GABA (dvs. farmaceutiska ämnen)
• Design: Fallrapport, brev till redaktör, konferensbidrag, avhandling, personlig åsikt eller kommentar
• Djurstudier, in vitro- och ex vivo- studier.
Datakällor och sökstrategi
Vi genomförde en elektronisk litteratursökning på PubMed för att identifiera relevanta studier. Sökningen genomfördes fram till början av februari 2020. Söksträngarna som användes vid sökning var GABA OCH (stress ELLER sömn) INTE (gabapentin ELLER pregabalin). Artiklar valdes enligt föredragna rapporteringsartiklar för systematiska granskningar och metaanalyser (PRISMA) -diagrammet ( Moher et al., 2015 ; Shamseer et al., 2015 ). En granskare (PH) valde självständigt papper enligt ovannämnda kriterier för inkludering och uteslutning. Följande information extraherades från alla publikationer:
• Publikationsinformation : författare, år, tidskrift
• Deltagaregenskaper : antal rekryterade deltagare, antal deltagare som ingår i studien, antal deltagare (intervention), antal deltagare (kontroll), antal deltagare (annan intervention), hälsostatus, kön och åldersintervall
• Studiedesign : design och förblindning
• Interventionsegenskaper : interventionstid, tvättperiod, GABA-format, GABA-typ (naturlig eller biosyntetisk), GABA-dos, andra interventionstyper och doser
• Kontrollegenskaper : närvaro / frånvaro av kontroll / placebo, kontroll / placebodoser
• Resultatmått : frågeformulär för stress och sömn, kortisol, kromogranin A (CgA), immunglobulin A (IgA), adrenokortikotropiskt hormon (ACTH), adiponektin, hjärtfrekvens och hjärtfrekvensvariation, blodtryck, EEG-variabler
• Anmärkningar : anteckningar om de faktorer som kan påverka resultat / datakvalitet.
Studiekvaliteten bedömdes också med hjälp av Cochrane Collaborations verktyg för att bedöma risken för partiskhet i randomiserade studier ( Higgins et al., 2011 ).
Resultat
Vi identifierade 5 912 publikationer och screenade dem för att vara berättigade med hjälp av inkludering och uteslutningskriterier. Inledningsvis exkluderades 3 989 djurstudier, därefter ytterligare 10 in vitro- studier på människor. Ett tusen trehundra fyrtiosex studier som inte mätte stress och sömnrelaterade resultat exkluderades. Slutligen uteslöts 554 studier som inte undersökte konsumtionen av naturlig eller biosyntetisk GABA. Fjorton studier uppfyllde alla inklusionskriterier inkluderades i denna översyn ( figur 1 ).
En granskare (PH) utvärderade kvaliteten på de studier som ingår i denna granskning med hjälp av Cochrane Collaborations verktyg för att bedöma risken för partiskhet i randomiserade studier ( Higgins et al., 2011 ; Figur 2)). Majoriteten av studierna kategoriserades som med en oklar risk för selektionsbias, eftersom endast en av dem rapporterade metoden som användes för slumpmässig sekvensgenerering och allokeringsdöljning. Prestationsförskjutning, detektionsbias och förslitning observerades ha låg risk eftersom de flesta studierna var dubbelblinda och rapporterade alla resultaten. Risken för att rapportera bias var oklar eftersom vi inte var säkra på om forskare analyserade och rapporterade alla resultat som kunde extraheras från deras valda metoder. Slutligen fanns det en oklar fördom för potentiell intressekonflikt eftersom en eller flera författare till elva studier var anställda av ett industriföretag vid tidpunkten för publiceringen.
Sammanfattningar av alla studier presenteras i Tabell 1 (Metoder) och Tabell 2 (Resultat).
Effekten av GABA-konsumtion på stress
Två experimentella studier undersökte effekten av att konsumera GABA-berikade naturprodukter (som te och ris) på stress. Även om majoriteten av deltagargrupperna rapporterades vara friska varierade dosen GABA, interventionens varaktighet och de åtgärder som användes för att bedöma stress avsevärt.
En nyligen genomförd studie av Hinton et al. (2019) som undersökte de akuta effekterna av GABA Oolong-konsumtion på stress visade att både GABA Oolong-te (2,01 mg GABA / 200 ml te) och standard Oolong te (0,25 mg GABA / 200 ml te ) undersöktes ) ökat genomsnittligt RR-intervall (tiden mellan två på varandra följande R-vågor i elektrokardiogrammet). GABA Oolong hade emellertid ett större inflytande på hjärtfrekvensvariabilitet (HRV), vilket framkallade en större förändring i RR-intervallet hos höga jämfört med lågt stressade individer. Effekterna av GABA på andra HRV-parametrar och subjektiv stress var inte signifikanta. En annan studie av Yoshida et al. (2015)visade att 8 veckors konsumtion av GABA-ris (16,8 mg GABA i 150 g GABA-ris / dag) förbättrade den subjektiva lugn och oro i mitten av studien vid den fjärde behandlingsveckan jämfört med vitt ris (4,1 mg GABA i 150 g GABA-ris / dag) bibehölls dock inte dessa effekter. De rapporterade också trender för minskad blodkortisol och ökade adiponektinnivåer i tillståndet GABA-ris (mot vitt ris) vid den 8: e veckan av behandlingen. De observerade emellertid inga effekter på adrenokortikotropiskt hormon (ACTH) under något stadium av interventionen.
Alla de åtta experimentella studierna undersökte effekterna av (i) singel ( Abdou et al., 2006 ; Fujibayashi et al., 2008 ; Nakamura et al., 2009 ; Okita et al., 2009 ; Kanehira et al., 2011 ; Yoto et al., 2012 ; Yamastsu et al., 2015 ) och (ii) upprepade ( Yamatsu et al., 2013 ) biosyntetisk GABA-konsumtion på stress - främst på psykofysiologiska parametrar, med doser mellan 20-100 mg och deltagarnas antal mellan 7–63.
Fujibayashi et al. (2008) visade att 30 mg GABA-intag ökade (i) total effekt (TP) 30 och 60 minuter efter intag jämfört med baslinjen och (ii) högfrekvent effekt (HF) 30 min efter intag jämfört med baslinjen, men de misslyckades med att visa mellan gruppskillnader och skillnader i andra HRV-parametrar. Däremot Okita et al. (2009) rapporterade att placebotabletten ökade LF / HF-förhållandet och hjärtfrekvensen (HR) 20 och 40 minuter efter konsumtion. Denna ökning observerades inte i GABA-tillståndet (31,8 mg GABA), men de fann effekterna av GABA-konsumtion på andra parametrar inklusive strokevolym, hjärtutgång, HF- och LF-effekt, systoliskt blodtryck (SBP), diastoliskt blodtryck (DBP ) och genomsnittligt blodtryck (MBP). Använd elektroencefalografi (EEG), experiment 1 frånAbdou et al. (2006) visade att 100 mg GABA i 200 ml vatten ökade förändringar i (i) alfa-vågor (jämfört med vattentillstånd) och (ii) alfa / beta-förhållande (jämfört med vatten och teanintillstånd). De rapporterade också en trend för minskade förändringar för betavågor i GABA jämfört med vattenförhållanden. Den enda 4 veckors långa interventionsstudien med biosyntetisk GABA observerade en ökning av kortisolnivåerna i placebogruppen efter 2 och 4 veckors GABA-användning, men GABA-gruppen visade inte en sådan ökning ( Yamatsu et al., 2013 ).
De andra studierna använde olika metoder för att inducera stress hos deltagarna. Yamastsu et al. (2015) använde Uchida-Kraepelin Psychodiagnostic Test (UKT; Kuraishi, 2000 ), en aritmetisk uppgift för att inducera stress, och visade att 20 mg GABA i kaffe (jämfört med endast kaffe och vattenförhållanden) minskade kromogranin A (CgA) nivåer 30 min efter konsumtion. En liknande studie med användning av UKT- och CgA-nivåer ( Kanehira et al., 2011 ) visade att konsumtion av både 25 och 50 mg GABA i en 250 ml hypoton dryck (jämfört med endast hypotonisk dryck) sänkte salivcgA och kortisol hos individer med kronisk trötthet . Den subjektiva spänningen / ångestpoängen var dock inte signifikant. Nakamura et al. (2009)mätt både CgA och HRV och fann att 28 mg GABA i 10 g choklad, jämfört med 20 g choklad ensamt, minskade LF / HF-effekten 6,5-9,5 min efter den aritmetiska uppgiften (dvs = 36,5-39,5 min efter intag) HF-effekten 12–15 minuter efter den aritmetiska uppgiften (dvs. = 42–45 min efter intag). De rapporterade också att CgA-värdena ökade i chokladets enda tillstånd 30 och 50 minuter (jämfört med baslinjen) efter intag, en effekt som inte observerades i GABA-chokladtillstånd. Den elektrofysiologiska studien av Yoto et al. (2012)använde EEG för att visa att UKT minskade alfa- och beta-bandeffekten, medan 30 minuter efter ett 100 mg GABA-kapsel (vs. placebokapsel) intag hade denna minskning minskat. Även om deltagarna inte rapporterade en subjektiv ökning av avslappning och minskning av spännings / ångest och upphetsningspoäng. Till skillnad från studierna ovan, experiment 2 från Abdou et al. (2006) använde däremot en verklig stressuppgift där akrofoba deltagare ombads att korsa en upphängd bro. De upptäckte att kontrollgrupperna immunglobulin A (IgA) nivåer minskade i mitten och slutet av bron, men 100 mg GABA kapselgrupper IgA-nivåer visade inte detta mönster.
Effekten av GABA-konsumtion på sömn
Två åtta veckors interventionsstudier undersökte effekten av att konsumera GABA-berikat ris på sömnen hos friska individer. Yoshida et al. (2015) , som studerade friska medelålders individer med dålig sömn, fann en trend för förbättrade känslor vid uppvaknande i GABA-ris (16,8 mg GABA i 150 g GABA-ris / dag) (vs. vitt ris − 4,1 mg GABA i 150 g vitt ris / dag) grupp vid den fjärde interventionsveckan och efter två veckors intervention (dvs. vid den 10: e veckan). De fann ingen effekt av GABA-ris på VAS-sömnighetspoäng. Omvänt Okada et al. (2000)rapporterade hos postmenopausala kvinnor att konsumtionen av 26,4 mg GABA-ris 3 gånger om dagen (jämfört med kontrollris) förbättrade sömnlöshetspoängen för Kupperman klimakteriet vid den fjärde veckan av behandlingen. Dessutom undersökte endast en fyra veckors lång studie effekten av biosyntetisk GABA-konsumtion på sömn hos friska äldre deltagare. Med hjälp av OSA-sömninventariet visade de förbättringar i början och underhållet av sömn, sömnighet på morgonen och återhämtning från trötthetsvärden i GABA-gruppen efter 4 veckors behandling, även om de inte fann skillnader mellan GABA och placebogrupper ( Yamatsu et. al., 2013 ).
Tre interventionsstudier på 1 till 3 veckor (om än med mycket låga provstorlekar) undersökte effekterna av biosyntetisk GABA-konsumtion på sömn hos individer med dålig sömnkvalitet (en med PSQI> 5 målskyttar och två med PSQI> 6 målskyttar; PSQI : Pittsburgh Sleep Quality Index). I sin första 1 veckors långa interventionsstudie, Yamatsu et al. (2016)visade att intaget av 100 mg GABA-kapsel (kontra kontroll) förbättrade känslor vid uppvaknande, objektivt uppmätt minskad sömntid och ökad total sömntid för icke-REM (N1, N2 och N3 / SWS) efter ingrepp. De observerade också trender för förbättrad PSQI, sömntillfredsställelse och lättare att somna poäng och ökad ljus Icke-REM sömntid och sömneffektivitet i GABA (kontra kontroll) tillstånd efter behandling. De hittade emellertid inte signifikanta effekter för djup icke-REM (N3 / SWS) sömntid och tid (dvs varaktighet), REM-sömntid, uppvaknande frekvens eller delta vågkraft. I deras andra interventionsstudie på 1 vecka, Yamatsu et al. (2015), som studerade medelålders sovande som rapporterade att de hade dålig sömn, observerade en trend för minskad sömnfördröjning endast i 100 mg GABA kapsel (kontra kontroll) tillstånd. Resultat från PSQI-total, sömntillfredsställelse, känsla av att vakna, lätthet att somna poäng och icke-REM-sömntidsfördröjning, REM-sömntid, icke-REM-sömntid, uppvaknande frekvens och delta-vågkraft var inte signifikanta för GABA endast jämfört med annan intervention (AVLE och AVLE + GABA) och kontrollgrupper. Den senaste 4 veckor långa interventionsstudien på detta område av Byun et al. (2018), som studerade medelålders sovande som rapporterade att de hade dålig sömn rapporterade att intaget av 300 mg GABA-tablett (kontra kontrolltablett) minskade sömnstiden efter interventionen. De fann också att N2-sömn (%) och sömnlöshetsindex (ISI) minskade, liksom PSQI-total, PSQI-sömnkvalitet, PSQI-sömnlatens och PSQI-total sömntidspoäng i GABA-gruppen (före vs. efterbehandling) emellertid misslyckades de med att hitta skillnader mellan GABA och placebo / grupp. Dessutom fanns inga statistiskt signifikanta effekter av PSQI-sömneffektivitetspoäng och total sömntid, steg 1 och 3 Icke-REM-sömn (%), REM (%), vakna efter sömnstart (WASO; min), REM- sömnfördröjning, sömneffektivitet, upphetsningsindex, apné-hypopneaindex (AHI) och andningsbesvär (RDI).
Diskussion
Sammanfattning av de viktigaste resultaten
Denna systematiska granskning syftade till att fastställa den nuvarande statusen för kunskap om effekterna av naturlig och biosyntetisk GABA-konsumtion på stress och sömn. Sammantaget visade vår genomgång av litteraturen att det fanns låga till måttliga bevis för GABAs stress (på grund av att det finns fler studier med positiva resultat) och låga bevis för GABAs sömnfördelar.
Metoderna för studierna som ingår i denna översikt varierade signifikant men inkluderade både subjektiva och objektiva mått på stress och sömn. Majoriteten av studierna fann inte signifikanta subjektiva förbättringar av stresspoäng efter att ha konsumerat en enda dos av antingen naturliga eller biosyntetiska former av GABA. Bevis för utökad GABA-användning är blandad, Yoshida et al. (2015) studie som rapporterade förbättrad lugn och oro i GABA (vs. kontroll) -gruppen vid den fjärde behandlingsveckan, men inte med GABA-användning utöver det. Å andra sidan förbättrades bara några av de subjektiva sömnvärdena inklusive sömnstörningar, känslor vid uppvaknande, insättande och underhåll av sömn, sömnighet på morgonen och återhämtning från trötthetsresultat när det var en långvarig användning av GABA i minst en vecka (Okada et al., 2000 ; Yamatsu et al., 2013 , 2016 ). Återstående studier visade antingen trender mot förbättringar eller obetydlig subjektiv förbättring av sömnen. Det kan mycket väl vara så att långvarig naturlig användning av GABA krävs för att framkalla subjektiv stress och sömnfördelar.
Påfrestning
På grund av GABA: s BBB-permeabilitetsproblem använde de flesta studierna autonoma nervsystemet (ANS) -relaterade åtgärder (såsom HRV, kortisol och CgA) för att undersöka effekterna av GABA-konsumtion på stress. Abdou et al. (2006) och Yoto et al. (2012) använde EEG för att utvärdera den centrala effekten av GABA. Studierna med ANS-relaterade åtgärder visade positiva men ganska motstridiga resultat. Hinton et al. (2019) rapporterade ökade RR-intervall i GABA-tillståndet som återspeglar mer stabil ANS-funktion genom en ökning av vagal aktivitet (indikerar minskat stressrespons) ( Camm et al., 1996 ). På samma sätt, även om inga behandlingsskillnader rapporterades mellan GABA och kontrollförhållanden, Fujibayashi et al. (2008)visade en ökad TP i GABA-tillstånd 30 och 60 minuter efter intag (jämfört med baslinjen) vilket indikerar ANS-funktionalitet och anpassningsförmåga och minskad stress ( Camm et al., 1996 ). Samma studie rapporterade ökad HF i GABA-tillstånd 30 minuter efter intag (jämfört med baslinjen) vilket indikerar ökad PNS-aktivitet och minskad stress ( Berntson et al., 1997 ). Ökade RR-intervall, TP och HF antyder att GABA utövar sina effekter genom parasympatisk förstärkning utan eller mindre sympatiska effekter.
Resten av studierna som använde ANS-mått visade det motsatta aktiveringsmönstret. LF / HF, en markör för SNS-aktivitet och sympatovagal balans som ökar under stressförhållanden ( Pagani et al., 1991 ) ökade antingen inte ( Okita et al., 2009 ) eller reducerades i GABA-tillståndet ( Nakamura et al., 2009 ). På liknande sätt CgA, ett protein som frigörs tillsammans med noradrenalin i SNS ( Dimsdale et al., 1992 ) och kortisol, ett glukokortikoidhormon som frigörs av binjurebarken via (i) frisättning av adrenokortikotrop hormon genom reglering av hypotalamus-hypofysen - binjurexeln och (ii) SNS-innerveringen ( Engeland och Arnhold, 2005 ) reducerades i GABA kontra kontrollförhållanden (Nakamura et al., 2009 ; Kanehira et al., 2011 ; Yamastsu et al., 2015 ), vilket indikerar minskade stressnivåer. Dessutom befanns IgA, ett glykoprotein som regleras av SNS ( Carpenter et al., 1998 ) som är lägre i ångest ( Graham et al., 1988 ), minskat i kontroll men inte under GABA-förhållanden under en stressig uppgift. ( Abdou et al., 2006 ), vilket tyder på en stressskyddande effekt av GABA. Enligt dessa studier inducerade GABA avkoppling genom att modulera det sympatiska nervsystemet.
Även om det inte finns någon enighet om vilken uppdelning av det autonoma nervsystemet som påverkas mest av GABA-intaget, finns det begränsade bevis för att GABA också korsar BBB och utövar biologiska effekter på CNS. Stressreduktion och avkoppling är förknippade med förbättrade alfasvängningar ( Nobre et al., 2008 ), minskad betaaktivitet ( Ray och Cole, 1985 ) och ökat alfa / beta-förhållande ( Liang et al., 2019 ; Yi Wen och Mohd Aris, 2020 ). I linje med detta har Abdou et al. (2006) observerade ökade förändringar för alfa-vågor och alfa / beta-förhållande i GABA (vs. placebo) tillstånd, vilket tyder på förbättrad avkoppling. På samma sätt har Yoto et al. (2012)rapporterade att både alfa- och beta-vågor minskade på grund av en stressuppgift, men 30 minuter efter GABA-intag minskade denna minskning i GABA (kontra kontroll) tillstånd, vilket indikerar en stressskyddande effekt av GABA. Dessa resultat antyder att GABA passerar BBB antingen i små eller fulla mängder för att utöva biologiska effekter på CNS.
Sammanfattningsvis verkar stressmarkörer för båda divisionerna av ANS och CNS påverkas av oralt GABA-intag. Det är dock viktigt att notera att de effektiva doserna för stressreducerande och / eller stressskyddande fördelar varierar från 2,01 till 100 mg, där de lägre doserna upp till 30 mg verkar påverka de autonoma markörerna för stress och en dos på 100 mg. verkar påverka de centrala markörerna för stress. Dessutom verkar effektiva doser för naturlig GABA vara lägre än för biosyntetiska former. Även om naturligt GABA-intag och stressforskning är mycket begränsat kan dessa resultat också hänföras till de andra bioaktiva föreningarna som finns naturligt i livsmedel som har stressreducerande fördelar såsom l-theanin ( Juneja et al., 1999 ) och epigallocatechin gallate (EGCG) i te ( Scholey et al., 2012). Ytterligare studier är motiverade för att undersöka (i) naturlig och biosyntetisk GABA-biotillgänglighet hos människor efter oralt intag för att förstå GABAs verkningsmekanism för varje typ av GABA, (ii) minimala och optimala naturliga och biosyntetiska GABA-doser som krävs för stressfördelar, och (iii) minimala och optimala naturliga och biosyntetiska GABA-doser som krävs för att påverka stressreduktion / avslappning perifert och centralt.
Sömn
Det finns bara mycket begränsade stödjande bevis för rollen av oralt GABA-intag för objektiv sömnförbättring. Byun et al. (2018) , vars deltagare fick dos 1 timme innan de sov, rapporterade att användning av GABA under fyra veckor minskade sömnfördröjningen i GABA-gruppen (vs. kontroll). På liknande sätt har Yamatsu et al. (2016) , med dosering 30 minuter före sömn, visade att en veckas GABA-intervention minskade sömnstiden och ökade den totala sömntiden för icke-REM i GABA (kontra kontroll) tillstånd. I en tidigare studie med samma doseringsregim, Yamatsu et al. (2015)observerade endast en trend mot minskad sömnfördröjning efter 1 veckas GABA-konsumtion. Alla tre studierna misslyckades med att visa fördelaktiga effekter av GABA-intag på andra sömnmarkörer, såsom sömneffektivitet, REM-sömntid, uppvakningsfrekvens etc. Dessa resultat tyder på att långvarigt GABA-intag (dvs. upprepad dosering över dagar) kan vara fördelaktigt för naturligt inducerande sömn snarare än att upprätthålla sömn, eftersom bevis visade att GABA främst påverkar sömnstart och tidiga sömnstadier som inträffar tidigt på natten (dvs. nattens första icke-REM), men inte de sömnstadier som inträffar senare på natten. Detta kan förklaras av den farmakokinetiska profilen för GABA, som kännetecknas av en snabb ökning (30 minuter efter oral administrering) och sedan minskning (60 minuter efter oral administrering) i plasmakoncentrationer. Med andra ord, den snabba höjningen i blodet kan GABA-nivåerna förklara varför det påverkar differentiellt tidiga sömnmarkörer. Dessutom finns det ett dubbelriktat samband mellan sömn och både akut och kronisk ångest där sömnstörningar observeras hos individer med ångest (Soehner och Harvey, 2012 ) och sömnstörningar kan förutsäga utvecklingen av en ångestsyndrom ( Neckelmann et al., 2007 ). Specifikt har ökad latens för sömn observerats vid ångest och relaterade störningar ( Cox och Olatunji, 2016 ) och stress ( Maskevich et al., 2020 ). Därför kan fördelarna med tidigt sömnstadium med GABA-konsumtion förknippas med GABAs stressreducerande egenskaper snarare än direkt sömnframkallande och / eller upprätthållande av fördelar i sig.. Bristen på sömnunderhållsrelaterade fördelar med GABA kan också förklaras av (i) små och ojämna gruppstorlekar som maskerar verkliga förbättringar, (ii) otillräckliga GABA-mängder som inte driver SWS- och REM-svar och (iii) som inte använder split -natt PSG / EEG och maskering av de betydande förändringar som bara kan vara uppenbara i olika delar av natten.
Upprepat GABA-intag över dagar kan förbättra parametrarna för tidig sömn; Det är dock viktigt att notera att doser som krävs för att framkalla sömnfördelar (mellan 100 och 300 mg för biosyntetisk GABA) verkar vara högre än för stressfördelar (varierar mellan 20 och 100 mg för biosyntetisk och 2,01 och 26,4 mg för naturliga GABA) och verkar kräva en långvarig användning (1–8 veckor) för att bara förbättra tidiga sömnåtgärder. Med detta sagt verkar doser som sträcker sig mellan 100 och 300 mg vara effektiva för att minska sömnstiden med långvarig användning av 1–4 veckor. Återigen är det viktigt att notera att alla sömnstudier som rapporterade förbättrade objektiva sömnmått använde biosyntetiska former av GABA. Framtida forskning krävs för att förstå (i) de minimala och optimala naturliga och biosyntetiska GABA-doserna som krävs för att påverka olika sömnsteg,
Begränsningar
Den pågående översynen var föremål för flera begränsningar. För det första var kvaliteten på många av de granskade studierna tveksam på grund av potentiella intressekonflikter, lågt deltagande antal och ojämna kontroll- och interventionsgrupper. För det andra har inte alla studier bedömt samma stress- och / eller sömnparametrar eller använt samma design, varför ingen kvantitativ metaanalys kunde utföras på grund av heterogeniteten hos de extraherade data. För det tredje, även om PICOS (patientintervention-kontroll-utfall-studiedesign) användes för att extrahera data, fanns det bara en datautdragare och inget validerat verktyg har använts. Slutligen, på grund av det begränsade antalet heterogena studier inom detta område, kunde den exakta dosen för effektivitet för både stress- och sömnfördelar inte fastställas varken i den aktuella översynen eller i den allmänna vetenskapliga litteraturen. Därmed,
Slutsats
Denna översikt erbjuder en omfattande bedömning av den aktuella GABA-litteraturen och visar att naturligt och biosyntetiskt GABA-intag kan ha fördelaktiga effekter på stress och sömn. På grund av små provstorlekar och heterogenitet hos de använda metoderna är det dock nödvändigt med ytterligare forskning för att fastställa dostid, varaktighet och svarsförhållanden för både naturliga och biosyntetiska former av GABA för att på ett tillförlitligt sätt framkalla akut eller kronisk stress och sömneffekter.
Uttalande om datatillgänglighet
Alla datamängder som presenteras i denna studie ingår i artikeln.
Författarens bidrag
PH skrev manuskriptet med inmatning från JG, JN och AS som också bidragit till revisionen av manuskriptet kritiskt för viktigt intellektuellt innehåll. Alla författare bidrog till artikeln och godkände den inlämnade versionen.
Finansiering
Erhållna medel från Unilever UK Central Resources Limited för att täcka publiceringsavgifter för öppen tillgång.
Intressekonflikt
PH är anställd av Unilever UK Central Resources Limited. JG, JN och AS har fått forskningsfinansiering, konsulttjänster, resestöd och talaravgifter från olika industriföretag.
Referenser
Abdou, AM, Higashiguchi, S., Horie, K., Kim, M., Hatta, H. och Yokogoshi, H. (2006). Avslappnings- och immunförstärkningseffekter av gamma-aminosmörsyra (GABA) -administrering hos människor. Biofaktorer 26, 201–208. doi: 10.1002 / biof.5520260305
Al-Sarraf, H. (2002). Transport av 14C-gamma-aminosmörsyra till hjärnan, cerebrospinalvätska och koroid plexus hos nyfödda och vuxna råttor. Dev. Brain Res. 139, 121–129. doi: 10.1016 / S0165-3806 (02) 00537-0
Bassett, ML, Mullen, KD, Scholz, B., Fenstermacher, JD och Jones, EA (1990). Ökat hjärnupptag av γ-aminosmörsyra i en kaninmodell av leverencefalopati. Gastroenterologi 98, 747-757. doi: 10.1016 / 0016-5085 (90) 90298-F
Berntson, GG, Bigger, JT Jr, Eckberg, DL, Grossman, P., Kaufmann, PG, Malik, M., et al. (1997). Hjärtfrekvensvariation: ursprung, metoder och tolkningsförbehåll. Psykofysiologi 34, 623–648. doi: 10.1111 / j.1469-8986.1997.tb02140.x
Boonstra, E., de Kleijn, R., Colzato, LS, Alkemade, A., Forstmann, BU och Nieuwenhuis, S. (2015). Neurotransmittorer som kosttillskott: effekterna av GABA på hjärnan och beteendet. Främre. Psykol. 6: 1520. doi: 10.3389 / fpsyg.2015.01520
Bouche, N., Lacombe, B. och Fromm, H. (2003). GABA-signalering: en bevarad och allestädes närvarande mekanism. Trender Cell. Biol. 13, 607–610. doi: 10.1016 / j.tcb.2003.10.001
Byun, JI, Shin, YY, Chung, SE och Shin, WC (2018). Säkerhet och effekt av gamma-aminosmörsyra från fermenterad risgrodd hos patienter med sömnlöshetssymptom: en randomiserad, dubbelblind studie. J. Clin. Neurol. 14, 291–295. doi: 10.3988 / jcn.2018.14.3.291
Camm, AJ, Malik, M., Bigger, JT, Breithardt, G., Cerutti, S., Cohen, RJ, et al. (1996). Pulsvariation: mätstandarder, fysiologisk tolkning och klinisk användning. Cirkulation 93, 1043–1065. doi: 10.1161 / 01.CIR.93.5.1043
Carpenter, GH, Garrett, JR, Hartley, RH och Proctor, GB (1998). Påverkan av nerver på utsöndringen av immunglobulin A i submandibulär saliv hos råttor. J. Physiol . 512, 567–573. doi: 10.1111 / j.1469-7793.1998.567be.x
Cox, RC och Olatunji, BO (2016). En systematisk genomgång av sömnstörningar vid ångest och relaterade störningar. J. Angst Disord. 37, 104–129. doi: 10.1016 / j.janxdis.2015.12.001
Cryan, JF och Dinan, TG (2012). Sinnesförändrande mikroorganismer: inverkan av tarmmikrobioten på hjärnan och beteendet. Nat. Pastor Neurosci. 13, 701–712. doi: 10.1038 / nrn3346
DeWoskin, D., Myung, J., Belle, MD, Piggins, HD, Takumi, T. och Forger, DB (2015). Distinkta roller för GABA över flera tidsskalor vid dygnsdagsvis tidtagning. Proc. Natl. Acad. Sci. USA 112, E3911–3919. doi: 10.1073 / pnas.1420753112
Dhakal, R., Bajpai, VK och Baek, K.-H. (2012). Produktion av gaba (γ - aminosmörsyra) av mikroorganismer: en översyn. Braz. J. Microbiol. 43, 1230–1241. doi: 10.1590 / S1517-83822012000400001
Diana, M., Quílez, J. och Rafecas, M. (2014). Gamma-aminosmörsyra som en bioaktiv förening i livsmedel: en översyn. J. Funct. Livsmedel 10, 407–420. doi: 10.1016 / j.jff.2014.07.004
Dimsdale, JE, O'Connor, DT, Ziegler, M. och Mills, P. (1992). Kromogranin A korrelerar med noradrenalinfrisättningshastighet. Life Sci. 51, 519–525. doi: 10.1016 / 0024-3205 (92) 90029-O
Engeland, WC och Arnhold, MM (2005). Neurala kretsar vid reglering av binyrebarkens kortikosteronrytm. Endokrin 28, 325–332. doi: 10.1385 / ENDO: 28: 3: 325
Erdö, SL (1985). Perifera GABAergiska mekanismer. Trender Pharmacol. Sci. 6, 205–208. doi: 10.1016 / 0165-6147 (85) 90096-3
Fujibayashi, M., Kamiya, T., Takagaki, K. och Moritani, T. (2008). Aktivering av autonoma nervsystemets aktivitet genom oral intag av GABA. Nippon Eiyo Shokuryo Gakkaishi 61, 129–133. doi: 10.4327 / jsnfs.61.129
Gottesmann, C. (2002). GABA-mekanismer och sömn. Neurovetenskap 111, 231–239. doi: 10.1016 / S0306-4522 (02) 00034-9
Graham, NM, Bartholomeusz, RC, Taboonpong, N. och La Brooy, JT (1988). Minskar ångest utsöndringsgraden av sekretorisk IgA i saliv? Med. J. Austr. 148, 131–133. doi: 10.5694 / j.1326-5377.1988.tb112773.x
Higgins, JPT, Altman, DG, Gøtzsche, PC, Jüni, P., Moher, D., Oxman, AD, et al. (2011). Cochran-samarbetets verktyg för att bedöma risken för partiskhet i randomiserade studier. Br. Med. J. 343: d5928. doi: 10.1136 / bmj.d5928
Hinton, T., Jelinek, HF, Viengkhou, V., Johnston, GA och Matthews, S. (2019). Effekt av GABA-berikat oolongte på att minska stress i en universitetskohort. Främre. Nutr. 6:27. doi: 10.3389 / fnut.2019.00027
Jie, F., Yin, G., Yang, W., Yang, M., Gao, S., Lv, J., et al. (2018). Stress vid reglering av GABA-amygdala-systemet och relevans för neuropsykiatriska sjukdomar. Främre. Neurosci. 12: 562. doi: 10.3389 / fnins.2018.00562
Juneja, LR, Chu, D.-C., Okubo, T., Nagato, Y. och Yokogoshi, H. (1999). L-teanin - en unik aminosyra av grönt te och dess avslappningseffekt hos människor. Trender Mat Sci. Technol. 10, 199–204. doi: 10.1016 / S0924-2244 (99) 00044-8
Kanehira, T., Nakamura, Y., Nakamura, K., Horie, K., Horie, N., Furugori, K., et al. (2011). Att lindra yrkesmässig utmattning genom konsumtion av en dryck som innehåller gamma-aminosmörsyra. J. Nutr. Sci. Vitaminol. 57, 9–15. doi: 10.3177 / jnsv.57.9
Knudsen, GM, Poulsen, HE, och Paulson, OB (1988). Blod-hjärnbarriärpermeabilitet vid galaktosamininducerad leverencefalopati: inga bevis för ökad GABA-transport. J. Hepatol. 6, 187–192. doi: 10.1016 / S0168-8278 (88) 80030-8
Kuraishi, S. (2000). Utveckling av det "uchida-kraepelin psykodiagnostiska testet" i Japan. Psychologia 1, 104–109.
Kuriyama, K. och Sze, PY (1971). Blod-hjärnbarriär mot H3-y-aminosmörsyra i normala djur och aminooxiättiksyra-behandlade djur. Neurofarmakologi 10, 103–108. doi: 10.1016 / 0028-3908 (71) 90013-X
Li, H., Qiu, T., Huang, G. och Cao, Y. (2010). Produktion av gamma-aminosmörsyra med lactobacillus brevis NCL912 med användning av matad satsjäsning. Microb. Cellfakta. 9:85. doi: 10.1186 / 1475-2859-9-85
Liang, G., Xu, X., Zheng, Z., Xing, X. och Guo, J. (2019). EEG-signalindikator för emotionell reaktivitet, ” Paper presenterat vid den internationella konferensen om hjärninformatik (Haikou). doi: 10.1007 / 978-3-030-37078-7_1
Liao, W.-C., Wang, C.-Y., Shyu, Y.-T., Yu, R.-C. och Ho, K.-C. (2013). Inverkan av förbehandlingsmetoder och jäsning av adzukibönor på γ-aminosmörsyra (GABA) ackumulering av mjölksyrabakterier. J. Funct. Livsmedel 5, 1108–1115. doi: 10.1016 / j.jff.2013.03.006
Luppi, PH, Peyron, C. och Fort, P. (2017). Inte en enda men flera populationer av GABAergiska nervceller kontrollerar sömn. Sleep Med. Upp 32, 85–94. doi: 10.1016 / j.smrv.2016.03.002
Maskevich, S., Cassanet, A., Allen, NB, Trinder, J. och Bei, B. (2020). Sömn och stress hos ungdomar: rollen som upphetsning och hantering före sömnen under skolan och semestern. Sleep Med. 66, 130–138. doi: 10.1016 / j.sleep.2019.10.006
Moher, D., Shamseer, L., Clarke, M., Ghersi, D., Liberati, A., Petticrew, M., et al. (2015). Föredragna rapporteringspunkter för systematisk granskning och metaanalysprotokoll (PRISMA-P) 2015-uttalande. Syst. Upp 4: 1. doi: 10.1186 / 2046-4053-4-1
Nakamura, H., Takishima, T., Kometani, T. och Yokogoshi, H. (2009). Psykologisk stressreducerande effekt av choklad berikad med gamma-aminosmörsyra (GABA) hos människor: bedömning av stress med hjälp av hjärtfrekvensvariation och salivkromogranin A. Int. J. Food Sci. Nutr. 60, 106–113. doi: 10.1080 / 09637480802558508
Neckelmann, D., Mykletun, A. och Dahl, AA (2007). Kronisk sömnlöshet som en riskfaktor för att utveckla ångest och depression. Sov 30, 873–880. doi: 10.1093 / sleep / 30.7.873
Nemeroff, CB (2003). GABA: s roll i patofysiologin och behandlingen av ångeststörningar. Psykofarmakol. Tjur. 37, 133–146.
Nobre, AC, Rao, A. och Owen, GN (2008). L-teanin, en naturlig beståndsdel i te, och dess effekt på mentalt tillstånd. Asia Pacific J. Clin. Nutr. 17 (tillägg 1), 167–168.
Nuss, P. (2015). Ångeststörningar och GABA-neurotransmission: en störning av modulering. Neuropsykiatr. Dis. Behandla. 11, 165–175. doi: 10.2147 / NDT.S58841
Okada, T., Sugishita, T., Murakami, T., Murai, H., Saikusa, T., Horino, T., et al. (2000). Effekt av den avfettade risbakterien berikad med GABA för sömnlöshet, depression, autonom störning genom oral administrering. Nippon Shokuhin Kagaku Kogaku Kaishi 47, 596–603. doi: 10.3136 / nskkk.47.596
Okita, Y., Nakamura, H., Kouda, K., Takahashi, I., Takaoka, T., Kimura, M., et al. (2009). Effekter av grönsak som innehåller gamma-aminosmörsyra på hjärtets autonoma nervsystem hos friska unga människor. J Physiol. Antropol. 28, 101–107. doi: 10.2114 / jpa2.28.101
Olney, JW (1990). Excitotoxiska aminosyror och neuropsykiatriska störningar. Annu. Pastor Pharmacol. Toxicol. 30, 47–71. doi: 10.1146 / annurev.pa.30.040190.000403
Pagani, M., Mazzuero, G., Ferrari, A., Liberati, D., Cerutti, S., Vaitl, D., et al. (1991). Sympathovagal interaktion under mental stress. En studie med spektralanalys av hjärtfrekvensvariation hos friska kontrollpersoner och patienter med tidigare hjärtinfarkt. Cirkulation 83 (tillägg 4), 1143–1151.
Petroff, OA (2002). GABA och glutamat i människans hjärna. Neuroscientist 8, 562–573. doi: 10.1177 / 1073858402238515
Rashmi, D., Zanan, R., John, S., Khandagale, K. och Nadaf, A. (2018). Kapitel 13 - γ-aminosmörsyra (GABA): biosyntes, roll, kommersiell produktion och applikationer. Hingst. Nat. Produkter Chem. 57, 413–452. doi: 10.1016 / B978-0-444-64057-4.00013-2
Ray, W. och Cole, H. (1985). EEG alfa-aktivitet återspeglar uppmärksamhetskrav, och beta-aktivitet återspeglar emotionella och kognitiva processer. Vetenskap 228, 750–752. doi: 10.1126 / science.3992243
Riemann, D., Nissen, C., Palagini, L., Otte, A., Perlis, ML och Spiegelhalder, K. (2015). Neurobiologi, undersökning och behandling av kronisk sömnlöshet. Lancet Neurol. 14, 547–558. doi: 10.1016 / S1474-4422 (15) 00021-6
Roberts, E. (1974). γ-aminosmörsyra och nervsystemets funktion - Ett perspektiv. Biochem. Pharmacol. 23, 2637-2649. doi: 10.1016 / 0006-2952 (74) 90033-1
Roberts, E. och Eidelberg, E. (1960). Metaboliska och neurofysiologiska roller av gamma-aminosmörsyra. Int. Pastor Neurobiol. 2, 279–332. doi: 10.1016 / S0074-7742 (08) 60125-7
Roberts, E. och Frankel, S. (1950). gamma-aminosmörsyra i hjärnan: dess bildning av glutaminsyra. J. Biol. Chem. 187, 55–63.
Satya Narayan, V. och Nair, PM (1990). Metabolism, enzymologi och möjliga roller av 4-aminobutyrat i högre växter. Fytokemi 29, 367–375. doi: 10.1016 / 0031-9422 (90) 85081-P
Scholey, A., Downey, LA, Ciorciari, J., Pipingas, A., Nolidin, K., Finn, M., et al. (2012). Akuta neurokognitiva effekter av epigallocatechin gallate (EGCG). Aptit 58, 767–770. doi: 10.1016 / j.appet.2011.11.016
Schwartz, RD (1988). GABAa-receptorgaterade jonkanaler: biokemiska och farmakologiska studier av struktur och funktion. Biochem. Pharmacol. 37, 3369–3375. doi: 10.1016 / 0006-2952 (88) 90684-3
Shamseer, L., Moher, D., Clarke, M., Ghersi, D., Liberati, A., Petticrew, M., et al. (2015). Föredragna rapporteringsobjekt för systematisk granskning och metaanalysprotokoll (PRISMA-P) 2015: utarbetande och förklaring. Br. Med. J. 350: g7647. doi: 10.1136 / bmj.g7647
Shyamaladevi, N., Jayakumar, AR, Sujatha, R., Paul, V. och Subramanian, EH (2002). Bevis för att kväveoxidproduktion ökar gamma-aminosmörsyras permeabilitet i blod-hjärnbarriären. Brain Res. Tjur. 57, 231–236. doi: 10.1016 / S0361-9230 (01) 00755-9
Soehner, AM och Harvey, AG (2012). Förekomst och funktionella konsekvenser av allvarliga sömnlöshetssymptom vid humör och ångest: resultat från ett nationellt representativt urval. Sov 35, 1367–1375. doi: 10.5665 / sleep.2116
Steward, FC, Thompson, JF och Dent, CE (1949). γ-aminosmörsyra: en beståndsdel i potatisknölen? Vetenskap 110, 439–440.
Takanaga, H., Ohtsuki, S., Hosoya, K. och Terasaki, T. (2001). GAT2 / BGT-1 som ett system som ansvarar för transporten av gamma-aminosmörsyra vid musblod-hjärnbarriären. J. Cereb. Metab för blodflöde. 21, 1232–1239. doi: 10.1097 / 00004647-200110000-00012
Yamastsu, A., Yoneyama, M., Kim, M., Yamashita, Y., Horie, K., Yokogoshi, H., et al. (2015). De positiva effekterna av kaffe på stress och trötthet kan förbättras genom tillsats av GABA - En randomiserad, dubbelblind, placebokontrollerad, crossover-designad studie. Jpn. Pharmacol. Ther. 43, 515–519.
Yamatsu, A., Yamashita, Y., Horie, K., Takeshima, K., Horie, N., Masuda, K., et al. (2013). GABA: s gynnsamma verkan vid sömn och frekvent urinering på natten hos äldre. Jpn. Pharmacol. Ther. 41, 985–988.
Yamatsu, A., Yamashita, Y., Maru, I., Yang, J., Tatsuzaki, J. och Kim, M. (2015). Förbättring av sömn genom oralt intag av GABA och apocynum venetum leaf extract. J. Nutr. Sci. Vitaminol. 61, 182–187. doi: 10.3177 / jnsv.61.182
Yamatsu, A., Yamashita, Y., Pandharipande, T., Maru, I. och Kim, M. (2016). Effekt av oral gamma-aminosmörsyra (GABA) på sömn och dess absorption hos människor. Mat Sci. Bioteknik. 25, 547–551. doi: 10.1007 / s10068-016-0076-9
Yi Wen, T. och Mohd Aris, SA (2020). Elektroencefalogram (EEG) stressanalys på alfa / beta-förhållande och teta / beta-förhållande. Ind. J. Elect. Eng. Komp. Sci. 17: 175. doi: 10.11591 / ijeecs.v17.i1.pp175-182
Yoshida, S., Haramoto, M., Fukuda, T., Mizuno, H., Tanaka, A., Nishimura, M., et al. (2015). Optimering av en γ-aminosmörsyra (GABA) anrikningsprocess för vitt ris av hokkaido och effekterna av GABA-anrikat vitt ris på stressavlastning hos människor. Nippon Shokuhin Kagaku Kogaku Kaishi 62, 95–103. doi: 10.3136 / nskkk.62.95
Yoto, A., Murao, S., Motoki, M., Yokoyama, Y., Horie, N., Takeshima, K., et al. (2012). Oralt intag av γ-aminosmörsyra påverkar humör och aktiviteter i centrala nervsystemet under stressat tillstånd som orsakas av mentala uppgifter. Aminosyror 43, 1331–1337. doi: 10.1007 / s00726-011-1206-6
Nyckelord: gammaaminosmörsyra (GABA), stress, sömn, näringsämnen, kosttillskott
Citation: Hepsomali P, Groeger JA, Nishihira J och Scholey A (2020) Effekter av oral Gamma-aminosmörsyra (GABA) -administration på stress och sömn hos människor: En systematisk granskning. Främre. Neurosci. 14: 923. doi: 10.3389 / fnins.2020.00923
Mottagen: 7 maj 2020; Accepterat: 10 augusti 2020;
Publicerad: 17 september 2020.
Granskats av:
Daniela Calvetti , Case Western Reserve University, USAHercules Rezende Freitas , UC Davis MIND Institute, USA
Copyright © 2020 Hepsomali, Groeger, Nishihira och Scholey. Detta är en artikel med öppen tillgång som distribueras under villkoren i Creative Commons Attribution License (CC BY) . Användning, distribution eller reproduktion i andra forum är tillåten, förutsatt att den ursprungliga författaren (arna) och upphovsrättsinnehavaren (arna) krediteras och att den ursprungliga publikationen i denna tidskrift citeras, i enlighet med accepterad akademisk praxis. Ingen användning, distribution eller reproduktion är tillåten som inte uppfyller dessa villkor.
* Korrespondens: Piril Hepsomali, piril.hepsomali@unilever.com
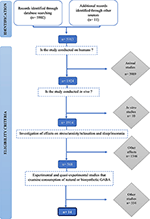
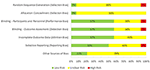
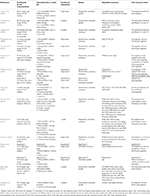
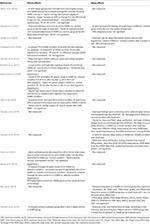

Inga kommentarer:
Skicka en kommentar
Om någon känner sig felaktigt behandlad i denna blogg. Lämna meddelande på sidan så kommer felaktigheter att behandlas. Ni andra, lämna gärna förslag på ämnen ni vill veta mer om.